
【题目】把1L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含0.2 molNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含0.5molBaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.0.3mol·L-1B.1.6mol·L-1
C.0.6mol·L-1D.0.8mol·L-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100mL溶液。
②量取10.00mLKMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积20.00mL,所发生反应的离子方程式如下:4H++5Fe2++MnO4-=5Fe3++Mn2++4H2O请回答下列问题:
(1)(NH4)xFe(SO4)2·6H2O中x=___,c(Fe2+)=___。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外还有___;
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定容操作。下列图对应的操作规范的是___。
a.称量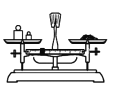 b.溶解
b.溶解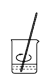 c.转移
c.转移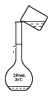 d.定容
d.定容![]()
(3)计算KMnO4溶液的物质的量浓度,写出计算过程。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
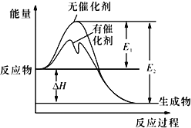
A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能小于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应正向反应过程中能量变化如图,下列说法正确的是
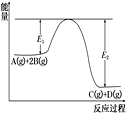
A. 该反应为吸热反应
B. 加入催化剂,反应速率增大,E1减小,E2减小,反应热不变
C. 增大压强,平衡正向移动,K增大
D. 当反应υ正(B)∶υ正(D)=2∶1时,到达平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着老百姓生活水平的提高,汽车进入寻常百姓家,在发生剧烈的汽车碰撞时,汽车安全气囊会发生反应10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
K2O+5Na2O+16N2↑,有关该反应说法正确的是( )
A.氧化剂与还原剂的物质的量之比为5:1B.N2既是氧化产物也是还原产物
C.NaN3是氧化剂D.KNO3发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=2的醋酸溶液,下列叙述正确的是( )
A. 该醋酸溶液的浓度为0.01mol/L
B. 加入少量CH3COONa固体,c(CH3COOH)增大
C. 溶液中离子浓度关系满足c(H+)>c(OH-)+c(CH3COO-)
D. 与等体积、pH=12的NaOH溶液混合后所得的溶液中c(Na+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。___
(2)若通入CO2气体为2.24L(标准状况下),得到9.5g的白色固体。
①请通过计算确定此白色固体组成为___。
②所用的NaOH溶液的物质的量浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烧碱、纯碱等都是重要的化工原料。
(1)利用如图装置可以证明二氧化碳与烧碱溶液发生了反应。
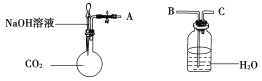
①若将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是________开始反应时的离子方程式是_______。
②若其他操作不变,将A与C连接,可观察到的现象是_______。
(2)向100mL 1mol·L-1烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是Ⅰ.NaOH、Na2CO3,Ⅱ.________,Ⅲ.Na2CO3、NaHCO3,Ⅳ.________。
①常温下,将得到的固体X重新溶于水,在所得溶液中加入盐酸,使溶液的pH=7,再将溶液蒸干,得到固体的质量为________g。
②若要验证白色固体X是第Ⅰ种组成,依次加入的试剂为________(填字母序号)。
a.盐酸 b.MgCl2溶液 c.BaCl2溶液 d.Ba(OH)2溶液 e.酚酞试液
在验证的过程中,一定需要进行的操作是________(填字母序号)。
a.萃取 b.洗涤 c.过滤 d.分馏
③若白色固体X为第Ⅲ种组成,下列实验方案中不能测定其中NaHCO3质量分数的是________。
a.取m g X与足量Ba(OH)2溶液充分反应,过滤,洗涤,烘干得n g固体
b.取m g X与足量盐酸充分反应,加热,蒸干,灼烧得n g固体
c.取m g X充分加热,质量减少n g
d.取m g X与足量稀硫酸充分反应,逸出的气体被足量碱石灰吸收,增重n g
④若白色固体X的质量为7.0g,则X的组成为________(填“Ⅰ”、“Ⅱ”、“Ⅲ”或“Ⅳ”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质在水溶液中存在各种行为,如电离、水解、沉淀溶解,据所学知识回答下列问题:
(1)t℃时,纯水中c(H+)=1×10-6 mol·L-1, 在该温度下,0.05mol/L的Ba(OH)2溶液的pH=________;
(2)在NaHS溶液中物料守恒:_________
(3)将AgCl分别放入:①5 mL水②40 mL 0.3mol·L-1 盐酸溶液中溶解至溶液饱和③10mL0.1 mol·L-1 MgCl2溶液④20 mL 0.5mol·L-1 NaCl溶液 ,各溶液中Ag+的浓度分别为a、b、c、d,它们由大到小的排列顺序是_________(用字母表示)。
(4)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质中最适宜采用的是________(填选项字母)
A.KMnO4 B.H2O2 C.氯水 D.HNO3
(5)如图所示,是原电池的装置图。请回答:
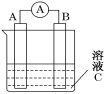
若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且作负极,则A电极上发生的电极反应式为______;反应进行一段时间后溶液C的pH将________(填“变大”、“变小”或“基本不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com