
|
已知: 若将 | |
| [ ] | |
A. |
6.7 |
B. |
9 |
C. |
10.4 |
D. |
12 |
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
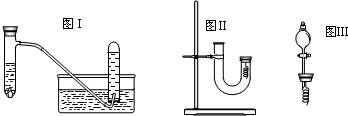
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
| 1 |
| 2 |
|
|
| 1 |
| 2 |
|
|
查看答案和解析>>
科目:高中化学 来源:湖北省武汉市武昌区2009届高三元月调研考试化学试题 题型:038
将3.2 g Cu溶于30 mL R mol/L过量硝酸溶液中,已知硝酸的还原产物只有NO2和NO,反应结束后,将所得溶液加水稀释至1.0 L,测得c(NO![]() )=0.20 mol/L.
)=0.20 mol/L.
(1)求稀释后溶液的pH.
(2)求生成的气体中NO2和NO的物质的量(用含有R的代数式表示).
(3)用NaOH溶液吸收氮的氧化物以防止污染,原理是:
NO+NO2+NaOH=2NaNO2+H2O,
2NO2+2NaOH=NaNO3+NaNO2+H2O.
若生成的混合气体能被NaOH溶液完全吸收,试讨论R的取值范围.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是______ |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是______ |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省常州市金坛市高一(下)期中化学试卷(解析版) 题型:解答题

| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是______ |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com