
【题目】(1)比较下列粒子的半径大小
①Na Mg O F __________
②Na+ Mg2+ O2- F-__________
③Fe Fe2+ Fe3+__________
④Na+ Mg2+ S2- Cl-__________
(2)下列物质中:只存在共价键的是__________(填序号,下同),只存在离子键的是__________,既存在离子键又存在极性共价键的是__________,既存在离子键又存在非极性共价键的是__________。
①Ar ②CO2 ③Na2O2 ④KOH ⑤MgBr2 ⑥NH4Cl ⑦CaO ⑧H2SO4
(3)氢气可由天然气和水反应制备,其主要反应为:CH4(g)+ 2H2O(g) ===CO2(g)+4H2(g) 反应过程中能量变化如图所示,则该反应为__________反应(填“吸热”或“放热”)。若已知,破坏1mol化学键需要吸收的热量如代数式表示:
化学键 | C—H | O—H | C=O | H—H |
吸收热量(kJ/mol) | a | b | c | d |

则根据该反应制取1mol H2要吸收或放出热量为___________kJ(用含a、b、c、d字母表示)。
【答案】![]()
![]()
![]()
![]() ②⑧ ⑤⑦ ④⑥ ③ 吸热
②⑧ ⑤⑦ ④⑥ ③ 吸热 ![]()
【解析】
(1)微粒半径大小比较的一般规律:一看电子层数、二看核电荷数、三看电子数;
(2)共价键:相邻原子间通过共用电子对形成的化学键;离子键:阴阳离子通过静电作用形成的化学键;同种元素原子之间形成的非极性共价键;不同种元素原子之间形成极性共价键;
(3)旧键断裂吸收能量,新键形成释放能量。
(1)①Na和Mg原子核外有3层电子,钠的质子数小,钠的半径大于镁,O和F原子核外两层电子,氧的质子数小,氧的半径大于氟,故答案为:![]() ;
;
②![]() 核外电子排布相同,质子数越大,半径越小,故答案为:
核外电子排布相同,质子数越大,半径越小,故答案为:![]() ;
;
③![]() 电子层数相同,都是4层, 电子数越多,半径越大, 故答案为:
电子层数相同,都是4层, 电子数越多,半径越大, 故答案为:![]() ;
;
④![]() 核外两层电子,
核外两层电子,![]() 核外三层电子,
核外三层电子,![]() 比
比![]() 半径小,电子层数相同时,质子数越大,半径越小,故答案为:
半径小,电子层数相同时,质子数越大,半径越小,故答案为: ![]() ;
;
(2)①Ar 单原子分子,不存在化学键;
②![]() 碳原子和氧原子形成极性共价键;
碳原子和氧原子形成极性共价键;
③![]() 中钠离子和过氧根离子间形成离子键,过氧根离子内部氧原子之间形成非极性共价键;
中钠离子和过氧根离子间形成离子键,过氧根离子内部氧原子之间形成非极性共价键;
④KOH中钾离子和氢氧根离子间形成离子键,氢氧根离子内部氧原子、氢原子间形成极性共价键;
⑤![]() 镁离子与溴离子间形成离子键;
镁离子与溴离子间形成离子键;
⑥![]() 铵根离子与氯离子间形成离子键,铵根离子内部氮原子、氢原子间形成极性共价键;
铵根离子与氯离子间形成离子键,铵根离子内部氮原子、氢原子间形成极性共价键;
⑦CaO钙离子和氧原子间形成离子键;
⑧![]() 氢原子与氧原子之间、氧原子与硫原子间均形成极性共价键;
氢原子与氧原子之间、氧原子与硫原子间均形成极性共价键;
故答案为:②⑧;⑤⑦;④⑥;③;
(3)根据能量变化图像,反应物能量比产物能量低,故该反应为吸热反应;![]() ,该反应中生成4mol氢气时会断裂4mol
,该反应中生成4mol氢气时会断裂4mol![]() 键和4mol
键和4mol![]() 键,形成2mol
键,形成2mol![]() 键和4mol
键和4mol![]() 键,吸收量为
键,吸收量为![]() ,故该反应制取1mol H2要吸收
,故该反应制取1mol H2要吸收![]() ,故答案为:
,故答案为:![]() 。
。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向1L 0.1 mo1.L-1NH4C1溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的浓度变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是

A. M点溶液中水的电离程度比原溶液大
B. 随着NaOH的加入,NH4+与NH3·H2O物质的量总量减少
C. 当n(NaOH)=0.05mol时,溶液中有:c(C1-)>c(Na+>c(NH4+>c(OH-)>c(H+)
D. 在M点时,n(OH-)+0.05=a+n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室用下图甲所示的装置制取乙酸乙酯。
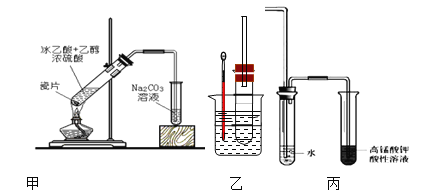
(1)饱和碳酸钠溶液的作用是:①_____ ;②________;③ ______
(2)右边装置中通蒸气的导管要插在液面上而不能插入溶液中,目的是防止_________
(3)分离得到乙酸乙酯的方法是_________ ,分离需要的玻璃仪器是 _________
(4)在制备乙酸乙酯实验中通常使用过量的乙醇目的是____________
II溴乙烷在不同溶剂中与NaOH可发生不同类型的反应,生成不同的反应产物。某同学依据溴乙烷的性质,用图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究。
(1)图乙在试管中加入5 mL 1 mol/L NaOH水溶液和5 mL 溴乙烷,
①水浴加热,优点是_________ 试管口安装一长导管的作用是___________
②鉴定生成物中乙醇的结构,可用的波谱是_______ 和 __________
(2)图乙在试管中加入5 mL NaOH乙醇溶液和5 mL 溴乙烷,水浴加热。
①请写出该反应的化学方程式______________
②为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,在设计的实验方案中,需要检验的是____,检验的装置如图丙所示,在气体通入酸性高锰酸钾溶液前加一个盛水的试管,其作用是____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物 WX2,Y原子内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
A. WX、WX2、ZX2的化学键类型完全相同
B. WZ2分子中所有原子最外层都满足8电子结构
C. 由于X的常见氢化物(H2X)分子间存在氢键,故H2X比H2Z 稳定
D. 原子半径大小顺序为X<W<Z<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱以及高强度、低密度,被美誉为“未来钢铁”、“战略金属”。
(1)基态钛原子核外共有_______种运动状态不相同的电子,价电子排布式_______;与钛同周期的元素中,基态原子的未成对电子数与钛相同的有________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是_________。
(3)TiCl4是氧化法制取钛的中间产物。TiCl4分子结构与CCl4相同,在常温下都是液体。TiCl4分子的空间构型是_______;TiCl4稳定性比CCl4差,试从结构分析其原因:_______。
(4)钙钛矿材料是一类有着与钛酸钙相同晶体结构的材料,这种奇特的晶体结构让它具备了很多独特的理化性质,比如吸光性、电催化性等。钛酸钙晶体结构如图所示。其中,A代表Ca2+,Ti原子位于由O原子构成的正八面体的中心,则钛酸钙的化学式为______,Ca2+的配位数是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂电池的总反应式为:2Li+FeS=Fe+Li2S[LiPF6SO(CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H24.48L。下列有关叙述不正确的是
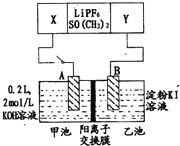
A.从隔膜中通过的离子数目为0.4NA
B.若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4mol/L
C.A电极为阳极
D.电源正极反应式为:FeS+2Li++2e-=Fe+Li2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(Ⅰ)、(Ⅱ)反应在一定条件下焓变及平衡常数如下:
2H2(g)+S2(g)2H2S(g) ΔH1 K1 (Ⅰ)
3H2(g)+SO2(g)2H2O(g)+H2S(g) ΔH2 K2 (Ⅱ)
(1)用ΔH1、ΔH2表示反应4H2(g)+2SO2(g)=S2(g)+4H2O(g)的ΔH=________。
(2)回答下列反应(Ⅰ)的相关问题:
①温度为T1,在1 L恒容容器中加入1.8 mol H2、1.2 mol S2,10 min时反应达到平衡。测得10 min内v(H2S)=0.08 mol·L-1·min-1,则该条件下的平衡常数为________。
②温度为T2时(T2>T1),在1 L恒容容器中也加入1.8 mol H2、1.2 mol S2,建立平衡时测得S2的转化率为25%,据此判断ΔH1________0(填“>”或“<”),与T1时相比,平衡常数K1__(填“增大”“减小”或“不变”)。
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是________________(写出主要反应的离子方程式),该溶液中,c(Na+)______2c(SO32-)+c(HSO3-)(填“>”“<”或“=”)。
②在某NaHSO3、Na2SO3混合溶液中HSO3-、SO32-物质的量分数随pH变化曲线如图所示(部分),根据图示,则SO32-的水解平衡常数=________。
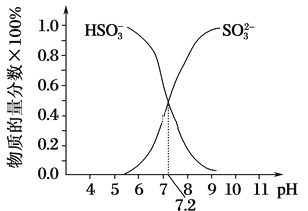
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3 和NaHCO3的说法错误的是
A. 等质量Na2CO3 和NaHCO3分别和足量盐酸反应,相同条件下前者生成CO2少
B. 将石灰水分别加入NaHCO3和Na2CO3中,前者不生成沉淀
C. 相同条件下Na2CO3 比NaHCO3更易溶于水
D. Na2CO3 固体中含少量NaHCO3,可用加热法除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com