
 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.分析 (1)根据题中反应原理及滴定过程判断,还需要指示剂淀粉和碘化钾溶液;
(2)注意称量的质量是10.000g食盐,必须使用电子天平,不能使用托盘天平;
(3)KIO3与KI反应完全,碘化钾溶液必须过量;根据滴定管的构造读出体积,必须读到0.01mL;
(4)反应原理设计了碘单质的反应,可以选用淀粉做指示剂;根据滴定终点的判断方法完成;
(5)根据反应方程式找出关系式IO3-~3I2~6S2O32-,计算出IO3-物质的量,就等于碘元素的物质的量,再计算出1kg食盐中含有的碘的质量;减少实验操作带来的误差,可以采用多次操作取平均值的方法;
(6)a、仰视读数,配制的溶液体积偏大,浓度偏小;
b、烧杯未洗涤并转移洗液,导致溶液中溶质的物质的量减小,配制的溶液浓度偏小;
c、滴定管漏液在锥形瓶外,消耗的标准液体积变大;
d、滴定前有气泡,导致消耗的标准液体积变大.
解答 解:(1)题中反应原理(1)IO3-+5I-+6H+→3I2+3H2O、(2)I2+2S2O32-═2I-+S4O62-,结合滴定过程,需要用淀粉做指示剂,还缺少碘化钾溶液,
故答案是:淀粉、KI溶液;
(2)根据质量要求达到0.001g,需要使用电子天平,还需要100mL容量瓶,
故答案是:100mL容量瓶、电子天平;
(3)加入的碘化钾溶液必须过量,才能使KIO3与KI反应完全;滴定管的每个小刻度线是0.10ml,两个滴定管读数相差0.10,读数应该是:20.80mL,
故答案是:过量;20.80;
(4)反应原理中有碘单质的反应,可以选用淀粉作为指示剂;滴定终点判断方法是:蓝色消失,半分钟保持不变,
故答案是:淀粉试液;蓝色消失,半分钟保持不变;
(5)有反应方程式:IO3-+5I-+6H+→3I2+3H2O、I2+2S2O32-═2I-+S4O62-,可得关系式:IO3-~3I2~6S2O32-,试样溶液10.00mL中:n(I)=n(IO3-)=$\frac{1}{6}$n(S2O32-)=$\frac{1}{6}$×0.0001 mol•L-1×(20.80-10.00)×10-3L=1.8×10-7mol,10.000g食盐含有的碘原子物质的量是1.8×10-6mol,1000g食盐中含有的碘原子的质量是:127×1.8×10-6×100=22.86mg,多次操作取平均值可以减小误差,
故答案是:22.86;多次实验后取平均值;
(6)a、精确配制100mL食盐溶液时,定容时仰视读数,导致配制的溶液的体积偏大,溶液中溶质的浓度偏小,滴定时消耗的标准液偏少,测定结果偏低,故a错误;
b、精确配制100mL实验溶液时,烧杯未洗涤并转移洗液,配制的溶液溶质的物质的量减少,溶液中溶质的浓度偏小,滴定时消耗的标准液偏少,测定结果偏低,故b错误;
c、滴定过程中,滴定管漏液在锥形瓶外,消耗的标准液变大,测定结果偏高,故c正确;
d、滴定前,滴定管下端尖嘴处由气泡,滴定后气泡消失,导致消耗的标准液体积变大,测定结果偏高,故d正确;
故选cd.
点评 本题考查了测定食盐中碘的含量方法,题量比较大,涉及了试剂选择、仪器选择、误差分析、含量计算等知识,注意合理分析题中信息,根据所学知识完成,本题难度中等.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:选择题
| A. | KN03 | B. | NH4NO3 | C. | CaC2 | D. | P4(白磷) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、K-、CIO-、Fe2+ | B. | OH-、Na+、Mg2+、Br- | ||
| C. | Cu2+、H+、CI-、NO3- | D. | Na+、SiO32-、Ca2+、CI- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质铁生成 | B. | 有气泡产生、最终有白色沉淀生成 | ||
| C. | 氧化剂只有H20 | D. | 被氧化的元素有钠、铁两种元素. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
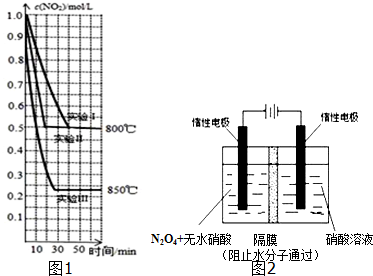
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.
”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.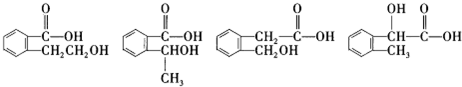 (任写两种).
(任写两种).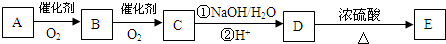
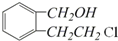 .
.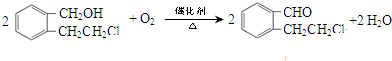 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>X | |
| B. | 元素X与M形成的化合物的空间构型可能是正四面体、直线型或平面型 | |
| C. | 将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种 | |
| D. | 由Z、M两种种元素形成的化合物一定只有极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
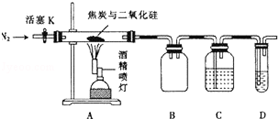 某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究.
某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com