
【题目】下列说法正确的是( )
A. pH在5.6~7.0之间的雨水通常称为酸雨
B. 新制氯水经光照一段时间后,pH增大
C. 燃煤时加入适量石灰石,可减少废气中SO2的含量
D. 测定某溶液pH时,应先用蒸馏水润湿pH试纸
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】某地有软锰矿和闪锌矿两座矿山,它们的组成(质量分数)如下:
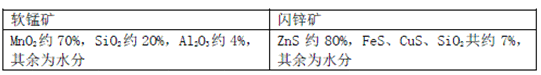
科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。
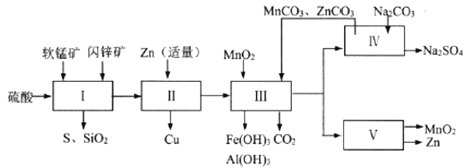
请回答下列问题。
(1)流程I所得滤液中含有MgSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等,则流程I中被氧化的物质有_______种。
(2)流程II中反应的离子方程式为_____________。
(3)氢氧化物开始沉淀的pH如下表:
氢氧化物 | Fe(0H)3 | Al(0H)3 | Fe(0H)2 |
开始沉淀pH | 1.5 | 3.3 | 7.6 |
①流程III中MnO2的作用是将Fe2+氧化成Fe3+,不直接生成Fe(OH)3沉淀的原因是_________。
②MnCO3和ZnCO3的作用是______________。
(4)下图是Na2SO4和Na2SO4·10H2O的溶解度(g/100g水)曲线,又知MnCO3和ZnSO4的溶解度随温度的升高而增大,则流程IV得到Na2SO4固体的操作是:将分离出MnCO3和ZnCO3后的滤液升温结晶、趁热过滤、_____、干燥,要“趁热”过滤的原因是:______________。
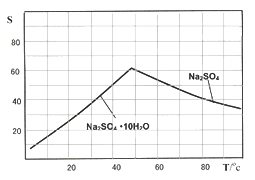
(5)本工艺所用的原料除软锰矿、闪锌矿、硫酸外还需要购买的原料是_______。
(6)流程V的反应为:MnSO4+ZnSO4+2H2O ![]() MnO2+Zn+2H2SO4,写出阳极反应式________。
MnO2+Zn+2H2SO4,写出阳极反应式________。
(7)MnO2和Zn可按物质的量之比1 : 1 生产锌-锰干电池,则从主产MnO2和Zn的角度计算,所用软锰矿和闪锌矿的质量比大约是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究铜与浓硫酸反应气体产物的性质,拟用下图所示的装置进行实验。

请回答下列问题:
(1)仪器X的名称为_________。
(2)Y溶液可以是________,相应的实验现象是____________________________________________________。
(3)丙装置的作用是______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟工业制取Na2SO3固体的过程如下:

已知:① 反应I在三颈烧瓶中发生,装置如图甲所示(固定及加热类仪器省略)。
② 部分物质的溶解度曲线如图乙所示,其中Na2SO3饱和溶液低于50℃时析出Na2SO3·7H2O。
(l)反应I的目的是制取(NH4)2SO3溶液。

① 反应I的离子方程式为____________。
② 亚硫酸分解产生的SO2须冷却后再通入氨水中,目的是____________。
③ 下列关于图甲装置或操作的叙述正确的是______(填字母)。
A.接入冷凝管的冷却水从a端通入
B.长玻璃导管具有防倒吸的作用
C. 控制加热亚硫酸的温度,可以控制生成SO2气体的速率
(2)为获取更多的Na2SO3固体,要将反应II的温度控制在80℃左右,并_______(填操作I的名称)。
(3)由滤液可以制取NH4Cl固体。
①验证滤液中含有NH4+的实验操作是________。
②由滤液可获得NH4Cl粗产品(含少量Na2SO3)。请补充完整由NH4Cl粗产品制取纯净的NH4Cl固体的实验方案:________,得到纯净的NH4Cl固体。(实验中须使用的试剂有SO2、乙醇,除常用仪器外须使用的仪器有:真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸高铈[Ce(SO4)2]是一种常用的强氧化剂。
(1)将Ce(SO4)2·4H2O(摩尔质量为404g/mol)在空气中加热,样品的固体残留率(![]() )随温度的变化如图所示。
)随温度的变化如图所示。

当固体残留率为70.3%时,所得固体可能为______(填字母)
A. Ce(SO4)2 B. Ce2(SO4)3 C. CeOSO4
(2)将一定质量的Ce(SO4)2·4H2O溶于50mL质量分数为60%、密度为1.47g/cm3的硫酸中,
再用水定容至l000mL,所得溶液中c(H+)=_______mol/L
(3)利用Ce(SO4)2标准溶液测定FeC2O4·2H2O(摩尔质量为180g/mol)和Fe(C2O4)3·4H2O(摩尔质量为448g/mol)固体混合物中FeC2O4·2H2O含量的方法如下:
步骤l:称量1.1240g固体混合物,溶于硫酸,向溶液中加入100.00mL 0.2000mol/L的Ce(SO4)2溶液。物质转化关系如下:![]()
步骤2:将反应后的溶液加水稀释并定容至250.00mL,取25.00mL于锥形瓶中,滴加指示剂,用0.01000mol/LFeSO4标准溶液滴定过量的Ce4+,终点时消耗FeSO4标准溶液20.00mL。
计算固体混合物中FeC2O4·2H2O的质量分数,写出计算过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸锰废液(主要含Mn2+、H+、SO42-,还含有少量Cl-、Zn2+、Cu2+)制取金属锰的流程如下:

(1)滤渣I的主要成分是CuCl,潮湿条件下易被空气氧化。过滤I操作时间不宜过长,其原因是_____________(用离子方程式表示)。
(2)若过滤I后所得滤液中Zn2+和Cu2+的浓度均为0.01mol/L,加入(NH4)2S溶液,先析出CuS沉淀,则Ksp(ZnS)_______Ksp(CuS)(填“>”或“<”)。除锌、铜时须控制溶液pH, pH过低,金属离子沉淀不完全,原因是_____________。
(3)写出电解过程中发生反应的化学方程式:_______。若不除去硫酸锰废液中的Cu2+、Zn2+、Cl-,则电解时会导致____________。
(4)向CuCl固体中加入一定量的NaCl溶液,反应过程中各粒子的物质的量随时间变化如图所示。写出该反应过程中的离子方程式:____________(X用对应粒子的化学式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1丁醇CH3CH2CH2CH20H和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如图,下列对该实验的描述错误的是

A. 不能用水浴加热
B. 长玻璃管起冷凝回流作用
C. 1丁醇和乙酸能反应完或者有一种能消耗完
D. 加入过量乙酸可以提高1丁醇的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com