
【题目】某同学通过实验研究钠及其化合物的有关性质,请回答相关问题.
(1)实验室中少量的钠通常保存在_______中,在实验室中取用钠的仪器是________.
(2)若将钠在空气中加热,钠会燃烧发出黄色火焰,同时生成 色的固体,写出该产物与H2O反应的化学方程式:________.
(3)将金属钠投入水中,发生反应的离子方程式为________
(4)该同学在实验室欲配制500mL0.1mol/L NaOH溶液.
①配制溶液时肯定不需要如图所示仪器中的________(填字母),配制上述溶液还需要用到的玻璃仪器是________(填仪器名称).
②根据计算,该同学应用托盘天平称取NaOH的质量为________.
③该同学将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L.下列操作会引起所配浓度偏大的是________.
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
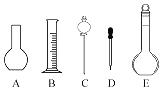
【答案】煤油 镊子2Na2O2+2H2O=4NaOH+O2↑2Na+2H2O=2Na++2OH﹣+H2↑AC烧杯玻璃棒2.0gCE
【解析】
(1)因为钠的密度比水小,在空气中容易被氧化,所以少量的钠通常保存在煤油中,在实验室中取用钠的仪器是镊子,故答案为:煤油;镊子;(2)钠在空气中加热燃烧生成淡黄色的Na2O2固体,Na2O2与H2O反应生成氢氧化钠和氧气,方程式为:2Na2O2+2H2O=4NaOH+O2↑;(3)金属钠投入水中生成氢氧化钠和氢气,离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;(4)①配制步骤为:计算→称量→溶解、冷却→移液→定容→摇匀→装瓶→贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,肯定不需要平底烧瓶(A)、分液漏斗(C),还需要的玻璃仪器是烧杯、玻璃棒;②实验室配制500mL0.1mol/L的NaOH溶液,质量为:0.5L×0.1mol/L×40g/mol=2.0g;③A.烧杯未进行洗涤,导致n偏小,则浓度偏小,故错误;
B.配制前,容量瓶中有少量蒸馏水,无影响,故错误;C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容,导致溶液体积偏小,则浓度偏大,故正确;D.往容量瓶转移时,有少量液体溅出,导致n偏小,则浓度偏小,故错误;E.在容量瓶中定容时俯视容量瓶刻度线,导致溶液体积偏小,则浓度偏大,故正确;F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致溶液体积偏大,则浓度偏小,故错误;故答案为:CE。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子,能在溶液中大量共存且溶液呈透明的是( )
A.Mg2+ 、H+ 、Cu2+ 、SO42-B.Ba2+ 、NO3- 、OH- 、CO32--
C.Ag+ 、H+ 、Cl- 、NO3-D.K+ 、H+ 、Cl- 、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为:4NH3+5O2![]() 4NO+6H2O,该反应的氧化剂为________,还原剂为________;用单线桥法表示该氧化还原反应电子转移的方向和数目:________;若有标准状况下VL氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为________(写出含字母的表达式)。
4NO+6H2O,该反应的氧化剂为________,还原剂为________;用单线桥法表示该氧化还原反应电子转移的方向和数目:________;若有标准状况下VL氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为________(写出含字母的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用光洁铂丝蘸取某无色溶液,在无色火焰上灼烧,火焰呈黄色,则无色溶液中
A.只有Na+B.一定有Na+,可能有K+
C.一定有Na+和K+D.可能有Na+和K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保险粉又称连二亚硫酸钠(Na2S2O4),可用于纺织工业的漂白剂、脱色剂,脱氯剂。Na2S2O4是白色粉末,无味,易溶于水、难溶于乙醇,具有极强的还原性,在空气中易被氧化,在碱性介质中稳定。
Ⅰ.甲酸钠(HCOONa)法制备过程如下:

(1)连二亚硫酸钠中硫元素的化合价为______________。
(2)实验室用Na2SO3 固体和某酸反应制备SO2气体,制备SO2时所选用的酸,你认为下列最适宜选用的是______________。
A.浓盐酸 B.浓硝酸
C.质量分数为70%的硫酸 D.质量分数为10%的硫酸
(3)步骤①中制备连二亚硫酸钠的化学方程式可表示为____________________________。
(4)上述步骤②中,加入适量乙醇水溶液的作用是______________。
(5)在包装保存“保险粉”时加入少量的Na2CO3固体,目的是_________________________。
(6)①现将0.05mol/L Na2S2O4溶液在空气中放置,其溶液的pH 与时间(t)的关系如图所示。

t1时溶液中只有NaHSO3一种溶质,此时含硫元素的粒子浓度由大到小的顺序为_______________。
②t1~t2段发生化学反应的离子方程式为______________________________。
Ⅱ.电解法制备:工业上用惰性电极电解NaHSO3溶液得到Na2S2O4。过程如图所示

(7)①产品在_________________(填“阳极”、“阴极”)得到。
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下列实验探究金属铝与不同铜盐溶液的反应:
实验 | 实验方案 | 现象 |
1 | 向5mLlmol/LCuSO4溶液中加入用砂纸打磨过的铝片 | 铝片表面无明显现象,20min后铝片表面有极少气泡,且有很少量红色物质生成 |
2 | 向5mLlmol/LCuCl2溶液中加入用砂纸打磨过的铝片 | 铝片表面有气泡产生,同时有红色物质析出,1min后反应进一步加快,放出大量的热,有少量黑色固体生成。一段时间后烧杯底部出现白色沉淀 |
(1)打磨铝片的目的是_____________________________。
(2)实验中出现的红色物质是_______________________________。
(3)实验2中“1min后反应进一步加快”的原因是________________________________。
(4)经检验实验1、2中产生的无色气体是H2,黑色固体为CuO,试用离子方程式解释H2产生的原因__________________________,用文字简述黑色固体产生的原因____________________________。
(5)依据上述实验1、2现象推测并判断,用砂纸打磨后的铝片分别与H+浓度均为0.2molL-1的盐酸和硫酸反应,反应速率:前者比后者____________(填“快”或“慢”)
(6)经证明实验2 中白色沉淀的化学成分为CuCl。某同学猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有________性。依据猜测他进行了如下实验:取Cu粉与适量1mol/LCuCl2溶液混合,一段时间后观察无白色沉淀产生。该同学再次分析Al 与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,他的改进方法为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,浓度均为0.1mol/L.体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
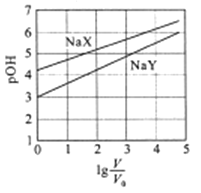
A. HX、HY都是弱酸,且Ka(HX)>Ka(HY)
B. 图中pOH随![]() 变化始终满足直线关系
变化始终满足直线关系
C. ![]() =3时,NaX溶液中所含离子总数小于NaY溶液
=3时,NaX溶液中所含离子总数小于NaY溶液
D. 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com