
引起下列环境污染的原因不正确的是( )
A.重金属、农药和难分解有机物等会造成水体污染
B.装饰材料中的甲醛、芳香烃及氡等会造成居室污染
C.SO2、NO2或CO2都会导致酸雨的形成
D.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Pb+![]()
![]() PbSO4+2e-
PbSO4+2e-
PbO2+4H++![]() +2e-
+2e-![]() PbSO4+2H2O
PbSO4+2H2O
充电时,两极发生的反应分别表示为:
PbSO4+2e-![]() Pb+
Pb+![]()
PbSO4+2H2O-2e-![]() PbO2+4H++
PbO2+4H++![]()
根据上述材料,回答(1)—(3)题。
(1)在放电时,下列说法正确的是( )
A.铅板为电源正极 B.铅板为电源负极
C.铅板在放电时发生氧化反应 D.铅板在放电时发生还原反应
(2)在蓄电池放电时,溶液的pH将( )
A.不变 B.升高 C.降低 D.无法确定
(3)在蓄电池生产和使用时,下列说法正确的是( )
A.生产和使用铅蓄电池时,不会造成环境污染
B.生产和使用铅蓄电池时,可能引起铅中毒和环境污染
C.使用铅蓄电池时,若铅板上有1 mol铅反应就消耗2 mol H2SO4
D.在使用时,电池内溶液的密度会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
“9·11”事件已过去多年,但其留给人们的伤害还存在。科学家曾警告说,随着美国世贸大厦的轰然倒下,原来在建筑大厦时用的大量石棉将释放出来污染环境(石棉有毒,能使人患肺癌)。石棉是一种具有压伸强度大、柔韧性强、耐热、耐火焰、耐酸碱腐蚀、价格低廉的硅酸盐。完成下列问题:
(1)有一种石棉叫矿青石棉,其分子式为Na2Fe5Si8O22(OH)2,其中铁的平均化合价为_______________,铁的氧化物的物质的量分数为____________(铁用氧化物的形式表示)。
(2)研究表明,在硅酸盐中,Al3+很容易取代Si4+,取代后不会引起原硅酸盐结构大的变化。从立体几何的知识看,Al3+与Si4+最直接的关系是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知蓄电池在放电时起原电池的作用,在充电时起电解池的作用。汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成。两个电极用硫酸溶液作电解质溶液。在放电时,两极发生的反应可分别表示为:
Pb+ SO42-![]() PbSO4+2e-
PbSO4+2e-
PbO2+4H++ SO42-+2e-![]() PbSO4+2H2O
PbSO4+2H2O
充电时,两极发生的反应分别表示为:
PbSO4+2e-![]() Pb+ SO42-
Pb+ SO42-
PbSO4+2H2O-2e-![]() PbO2+4H++ SO42-
PbO2+4H++ SO42-
根据上述材料,回答(1)—(3)题。
(1)在放电时,下列说法正确的是( )
A.铅板为电源正极 B.铅板为电源负极
C.铅板在放电时发生氧化反应 D.铅板在放电时发生还原反应
(2)在蓄电池放电时,溶液的pH将( )
A.不变 B.升高 C.降低 D.无法确定
(3)在蓄电池生产和使用时,下列说法正确的是( )
A.生产和使用铅蓄电池时,不会造成环境污染
B.生产和使用铅蓄电池时,可能引起铅中毒和环境污染
C.使用铅蓄电池时,若铅板上有1 mol铅反应就消耗2molH2SO4
D.在使用时,电池内溶液的密度会增大
查看答案和解析>>
科目:高中化学 来源:2014届甘肃省高三上学期期中考试理综化学试(解析版) 题型:填空题
(14分)2014年10月初,雾霾天气多次肆虐河北、天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)  2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应的平衡常数表达式 。
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
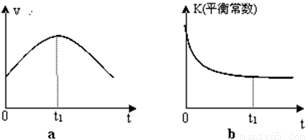
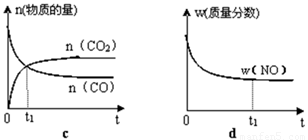
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g)
△H=-56.9 kJ/mol
N2O4(g)
△H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)在一定条件下,也可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。则2 molCH4与足量H2O(g)反应最多可生成_______mol H2,写出该反应的化学方程式_________________________________________________。
(5)上述方法制得的H2可以和CO在一定条件下合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com