
【题目】短周期元素W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族。W 与X 可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5 倍。下列叙述中不正确的是
A. WX2分子中所有原子最外层都为8 电子结构
B. 简单气态氢化物的沸点W的比X的低
C. WX2是以极性键结合成的非极性分子
D. 原子半径大小顺序为X <W<Y<Z
【答案】D
【解析】
短周期元素W、X、Y、Z的原子序数依次增大,Y原子的内层电子总数是其最外层电子数的2.5倍,Y有三个电子层,最外层电子数为4,故Y为硅元素;W与Y,则W为碳元素;W与X可形成共价化合物WX2,X处于第ⅥA族,X与Z分别位于同一主族,故X为氧元素,Z为硫元素。
短周期元素W、X、Y、Z的原子序数依次增大,Y原子的内层电子总数是其最外层电子数的2.5倍,Y有三个电子层,最外层电子数为4,故Y为硅元素;W与Y,则W为碳元素;W与X可形成共价化合物WX2,X为-2价,X处于第ⅥA族,X与Z分别位于同一主族,故X为氧元素,Z为硫元素。A. WX2为二氧化碳,电子式为![]() ,分子中所有原子最外层都为8 电子结构,选项A正确;B. 由于水分子间存在氢键,故甲烷的沸点低于水,选项B正确;C. CO2是以极性键结合成的非极性分子,选项C正确;D. 同周期元素从左到右原子半径依次减小,同主族元素从上而下原子半径依次增大,则原子半径大小顺序为O <C<S<Si,即X <W<Z<Y,选项D不正确。答案选D。
,分子中所有原子最外层都为8 电子结构,选项A正确;B. 由于水分子间存在氢键,故甲烷的沸点低于水,选项B正确;C. CO2是以极性键结合成的非极性分子,选项C正确;D. 同周期元素从左到右原子半径依次减小,同主族元素从上而下原子半径依次增大,则原子半径大小顺序为O <C<S<Si,即X <W<Z<Y,选项D不正确。答案选D。


科目:高中化学 来源: 题型:
【题目】一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)![]() 2C(g)达到平衡标志的是
2C(g)达到平衡标志的是
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④C的物质的量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a molA,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2
A. ⑤⑥B. ⑦④C. ①③D. ②⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、W、Z为四种短周期主族元素,在周期表中的位置如图所示。W原子的最外层电子数与电子层数相同,下列说法正确的是
![]()
A. X只能形成一种氢化物
B. W、X、Y的原子半径依次增大
C. X的简单氢化物的热稳定性比Y的小
D. W的最高价氧化物对应的水化物能溶于稀氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用3.0g乙酸和4.6g乙醇反应,若实际产率是理论产率的67%,则可得到的乙酸乙酯的质量为:
A. 2.95gB. 4.4gC. 7.48gD. 8.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
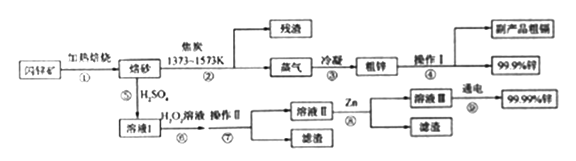
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度,其单质和化合物具有广泛的应用价值.氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品.以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1).

图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/kJmol﹣1 | 738 | 1451 | 7733 | 10540 | 13630 |
请回答下列问题:
(1)Ti的基态原子外围电子排布式为_____________.
(2)M是_____(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数为_____。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示.化合物甲的分子中采取sp2方式杂化的碳原子有__ 个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为________________。
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为____________________gcm﹣3(NA为阿伏加德罗常数的值,只列计算式)。该晶体中与N原子距离相等且最近的N原子有__________。
(5)科学家通过X﹣射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似.且知三种离子晶体的晶格能数据如下:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJmol﹣1 | 786 | 715 | 3401 |
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在环境保护中起着十分重要的作用,电化学降解NO3-的原理如图所示。下列说法不正确的是( )

A. 电解过程中,每转移1mol电子,则左侧电极就产生16g O2
B. 溶液中H+从阳极向阴极迁移
C. Ag-Pt电极的电极反应式为2NO3-+12H++10e-=N2↑+6H2O
D. B为电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究开发新的能源,如核能、太阳能、风能、地热、潮汐热等。“绿色能源”是目前正在研究的新能源之一,把高粱、玉米等绿色植物的种子经发酵、蒸馏就可以得到“绿色能源”中的一种。这种物质是
A.氢气 B.甲烷 C.酒精 D.木炭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像不符合反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
A. 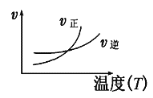 B.
B. 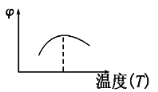
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com