
【题目】![]() 时,将
时,将![]() 溶液逐滴滴加到
溶液逐滴滴加到![]() 溶液中,所得溶液的
溶液中,所得溶液的![]() 与滴加
与滴加![]() 的体积关系如右图所示。下列指定溶液浓度关系说法正确的是
的体积关系如右图所示。下列指定溶液浓度关系说法正确的是
已知:![]() ,
,![]() 时
时![]() 的
的![]() ,
,![]() 。
。
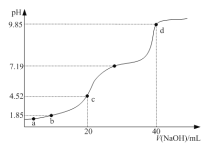
A.![]() 点所得溶液中:
点所得溶液中:![]()
B.![]() 点所得溶液中:
点所得溶液中:![]()
C.![]() 点所得溶液中:
点所得溶液中: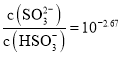
D.![]() 点所得溶液中:
点所得溶液中:![]()
【答案】CD
【解析】
A.当向溶液中滴加极少量NaOH时,溶液中c(Na+)极小,此时c(H+)>c(Na+),但随着NaOH的滴加,c(Na+)变大c(H+)变小,最终c(H+)<c(Na+),a点未告知滴加氢氧化钠的量无法判断c(H+)和c(Na+)的大小关系,故A错误;
B.b点溶液中溶质为H2SO3和NaHSO3,存在电荷守恒c(H+)+c(Na+)=c(OH)+c(HSO3)+2c(SO32),此时溶液显酸性,所以c(H+)> c(OH),则c(Na+)< c(HSO3)+2c(SO32),故B错误;
C.Ka2=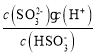 ,
,![]() ,则Ka2=10-7.19,c点溶液pH=4.52,即c(H+)=10-4.52mol/L,所以
,则Ka2=10-7.19,c点溶液pH=4.52,即c(H+)=10-4.52mol/L,所以 ,故C正确;
,故C正确;
D.d点加入0.1mol/LNaOH溶液40mL,恰好与亚硫酸钠完全反应,溶液中的溶质为Na2SO3,存在质子守恒c(OH)= c(H+)+ c(HSO3)+2 c(H2SO3),故D正确;
故答案为CD。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列叙述中错误的是( )
A.1mol铜与足量硫反应时转移电子数目为NA
B.31g白磷(分子式为P4)中含有P-P共价键数目为1.5NA
C.1molNa与一定量O2完全反应,生成Na2O和Na2O2混合物含有离子总数1.5NA
D.标准状况下,1mol氦气含有的质子数目为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空。
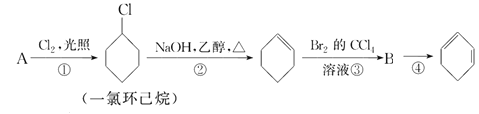
(1)A的结构简式是________,名称是________。
(2)①的反应类型是________,③的反应类型是________。
(3)反应②的化学方程式是_____________________________。
(4)反应③的化学方程式是_____________________________。
(5)反应④的化学方程式是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮醋酸(F)具有独特抗癌活性,它的合成路线如下:
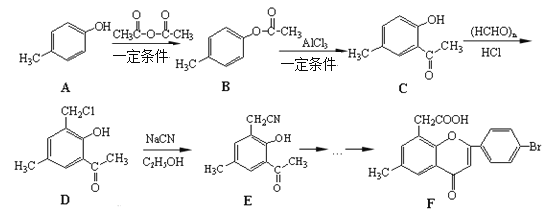
已知:RCN在酸性条件下发生水解反应: RCN ![]() RCOOH
RCOOH
(1)上述路线中A转化为B的反应为取代反应,写出该反应的化学方程式________。
(2)F分子中有3种含氧官能团,名称分别为醚键、_____________和______________。
(3)E在酸性条件下水解的产物可通过缩聚反应生成高分子化合物,该高分子化合物的结构简式为_________________________。一定条件
(4)写出一种符合下列条件的D.的同分异构体的结构简式________________。
①分子中有4种化学环境不同的氢原子
②可发生水解反应,且一种水解产物含有酚羟基,另一种水解产物含有醛基。
(5)对羟基苯乙酸乙酯(![]() )是一种重要的医药中间体。写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。______________
)是一种重要的医药中间体。写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选)。______________
合成路线流程图请参考如下形式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由甲烷、甲醛(HCHO)和乙烷组成的11.2升的混合气体完全燃烧后,生成0.7mol的二氧化碳气体。则混合气体中乙烷的体积分数为( )
A. 20%B. 40%C. 60%D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)![]() SiO2(s)+4HF(g)+148kJ
SiO2(s)+4HF(g)+148kJ
(1)写出该反应的平衡常数表达式:K=___________,若0~20min内,固体质量增加了6g,则20min内,用H2O表示该反应的平均速率是______________。
(2)下列各项中能说明该反应已达化学平衡状态的是_______(填字母序号)。
a. v正(SiF4)=4v逆(HF) b. c(SiF4):c(H2O)=1:2
c. 容器内气体的总质量不再变化 d. HF的体积分数不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1892年比利时人索尔维以NaCl、CO2、NH3、H2O为原料制得了纯净的Na2CO3,该法又称氨碱法,其主要生产流程如下。完成下列填空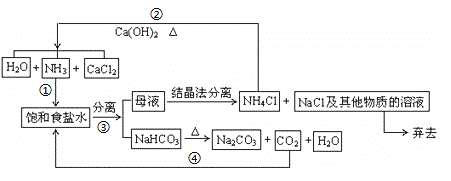
(1) 写出反应①中产生碳酸氢钠的离子方程式_________________________________。
(2)NaHCO3在水中溶解度较小,以沉淀形式析出,则图中③的操作名称___________________。从绿色化学原料的充分利用的角度看,该方法有明显的缺陷(答一条即可)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三价铁配合物的化学式可表示为Ka[Feb(C2O4)c]·xH2O,为测定其组成,进行如下实验:
步骤1:称取1.9640g该配合物晶体,配制成250.00mL溶液。
步骤2:取所配溶液25.00mL于锥形瓶中,加入1mol·L-1硫酸5.0mL,加热到70~85℃,用0.0100mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液48.00mL。
步骤3:向反应后的溶液中加入一定量锌粉。加热至黄色恰好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤4:继续用0.0100mol·L-1KMnO4溶液滴定步骤3所得溶液至终点,消耗KMnO4溶液8.00mL。
(1)步骤2中,KMnO4将C2O![]() 氧化为CO2,该滴定反应的离子方程式为___。
氧化为CO2,该滴定反应的离子方程式为___。
(2)步骤3中黄色消失的原因是___(用离子方程式表示)。
(3)配制配合物溶液的过程中,若定容时俯视容量瓶的刻度线,则最终所得晶体组成中水的含量___(填“偏大”“偏小”或“无影响”)。
(4)通过计算确定该三价铁配合物的化学式___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钡是一种重要的无机盐产品,广泛应用于工业陶瓷、光学玻璃、建筑等行业。
![]() 生产制备:工业上一般以重晶石
生产制备:工业上一般以重晶石![]() 为原料,采用高温煅烧还原法;实验室一般以重晶石
为原料,采用高温煅烧还原法;实验室一般以重晶石![]() 为原料,采用沉淀转化法。
为原料,采用沉淀转化法。
高温煅烧还原法:
![]()
![]() 煅烧还原的化学方程式为:_____________。
煅烧还原的化学方程式为:_____________。
![]() 为了提高浸取速率,可采取的措施是__________
为了提高浸取速率,可采取的措施是__________![]() 任写一种
任写一种![]() 。
。
![]() 经检验BaS的水溶液呈碱性,原因是
经检验BaS的水溶液呈碱性,原因是![]() 用离子方程式表示
用离子方程式表示![]() __________。
__________。
沉淀转化法:向![]() 沉淀中加入饱和
沉淀中加入饱和![]() 溶液,充分搅拌,弃去上层清液。如此处理多次,直到
溶液,充分搅拌,弃去上层清液。如此处理多次,直到![]() 全部转化为
全部转化为![]() :
:![]() 平衡常数
平衡常数![]()
![]() 现有
现有![]() ,每次用
,每次用![]() 饱和
饱和![]() 溶液处理,假定
溶液处理,假定![]() 能全部转化,至少需要处理_____________次。
能全部转化,至少需要处理_____________次。
![]() 从“绿色化学”角度分析,用饱和
从“绿色化学”角度分析,用饱和![]() 溶液沉淀转化法的优点是:__________。
溶液沉淀转化法的优点是:__________。
![]() 分离提纯
分离提纯
某实验室分离提纯混有少量碳酸钙杂质的碳酸钡样品的步骤如下:
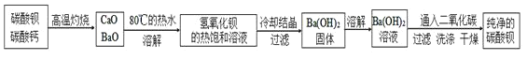
![]() 将灼烧后的固体混合物置于
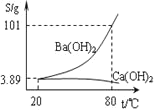
将灼烧后的固体混合物置于![]() 的热水中,制成氢氧化钡的热饱和溶液。为减少
的热水中,制成氢氧化钡的热饱和溶液。为减少![]() 的损失并除去不溶物应进行的操作是_____。
的损失并除去不溶物应进行的操作是_____。
![]() 向制得的
向制得的![]() 溶液中滴加_______
溶液中滴加_______![]() 填一种试剂名称
填一种试剂名称![]() ,再通入二氧化碳。当观察到_______时,即可停止通二氧化碳。
,再通入二氧化碳。当观察到_______时,即可停止通二氧化碳。
![]() 环境监测
环境监测
![]() 环境监测某工厂废水中
环境监测某工厂废水中![]() 的浓度。取废水
的浓度。取废水![]() ,控制适当的酸度加入足量的
,控制适当的酸度加入足量的![]() 溶液,得
溶液,得![]() 沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时
沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时![]() 全部转化为
全部转化为![]() ,再加入过量KI溶液,反应液中再滴加
,再加入过量KI溶液,反应液中再滴加![]() 溶液,反应完全时,消耗
溶液,反应完全时,消耗![]() 溶液
溶液![]() 。已知有关的离子方程式为:
。已知有关的离子方程式为:![]() ;
;![]() 。
。
该工厂废水中![]() 的物质的量浓度__________
的物质的量浓度__________![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com