
已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-57.3 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-1
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:填空题
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、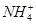 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、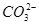 、
、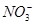 、
、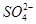 ,已知:
,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是 ;所含阴离子相同的两种盐的化学式是 。
(2)D的化学式为 ,D溶液显碱性的原因是 (用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是 ;
E和氨水反应的离子方程式是 。
(4)若要检验B中所含的阳离子,正确的实验方法是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子共存(解析版) 题型:选择题
下列各组离子在溶液中能够大量共存,当溶液中c(H+)=10-1 mol·L-1时有气体产生;而当溶液中c(H+)=10-13mol·L-1时又能生成沉淀。则该组离子可能是
A.Na+、Ba2+、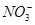 、
、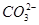
B.Ba2+、K+、Cl-、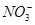
C.Mg2+、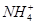 、
、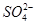 、Cl-
、Cl-
D.Fe2+、Na+、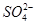 、
、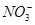
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学硅及其化合物主要性质、材料(解析版) 题型:选择题
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物。下表各组物质之间通过一步反应不能实现如图所示转化的是
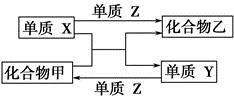
选项 | X | Y | Z | 甲 | 乙 |
A | H2 | Si | Cl2 | SiCl4 | HCl |
B | Mg | C | O2 | CO2 | MgO |
C | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
D | Cl2 | N2 | H2 | NH3 | HCl |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1 0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
下列反应不属于水解反应或水解方程式不正确的是
①HCl+H2O H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+
NH3·D2O+H+
A.①②③④ B.①②③
C.②③⑤ D.全部
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解规律及电化学计算(解析版) 题型:填空题
(1)将等物质的量的KI和CuCl2溶于水,用惰性电极电解,该电解反应可分为________个阶段(表格不一定填满,若不够还可以自行添加)。
阶段 | 相当于电解什么溶液 | 离子方程式 |
① |
|
|
② |
|
|
③ |
|
|
④ |
|
|
⑤ |
|
|
(2)画出过程中溶液pH随时间变化的曲线(假定生成的Cl2全部逸出)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学电解池的工作原理、电极反应式的书写(解析版) 题型:选择题
有关如图装置的叙述中,正确的是
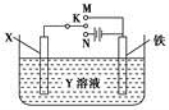
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为外接电源的阴极保护法
B.若X为碳棒,Y为饱和NaOH溶液,开关K置于N处,保持温度不变,则溶液的pH保持不变
C.若X为银棒,Y为硝酸银溶液,开关K置于N处,铁棒质量将增加,溶液中银离子浓度将减小
D.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铁电极移动
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及阿伏伽德罗常数(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25 ℃时,pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
B.室温下,14.0 g乙烯和丁烯的混合气体中含有C—H键数目为2.0NA
C.1 L 0.5 mol·L-1的(NH4)2SO4溶液中含有的NH数目为NA
D.标准状况下,22.4 L CCl4中含有共用电子对数目为4.0NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com