
【题目】浓硫酸中H3AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6M
①氧化剂是H3AsO3;②还原性:Cl->As;
③每生成7.5gAs,还原剂失去的电子为0.3 mol;
④M为OH-;⑤ SnCl62-是氧化产物。
关于该反应的说法中正确的组合是( )
A.①③⑤
B.①③
C.①②④⑤
D.①②③④
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下: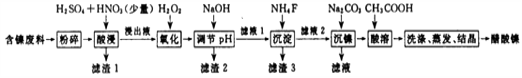
相关离子生成氢氧化物的pH和相关物质的溶解性如下表: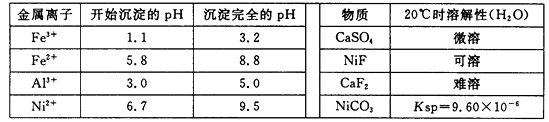
(1)调节pH步骤中,溶液pH的调节范围是。
(2)滤渣1和滤渣3主要成分的化学式分别是、。
(3)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式。
(4)沉镍前c(Ni2+)=2.0 mol· L-1 , 欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为g。(保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液。下列说法正确的是( )
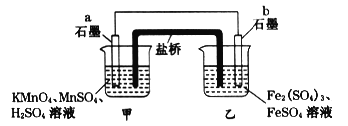
A. a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. b电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列操作中,一般情况下不能相互接触的是( )
A.过滤时,玻璃棒与三层滤纸
B.用量筒从食盐溶液中量出4.3 mL溶液
C.过滤时,烧杯内壁与漏斗下端
D.用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)+nB(g) ![]() pC(g)达到平衡后,升高温度,B的转化率变大;当减小压强,C的体积分数减小。
pC(g)达到平衡后,升高温度,B的转化率变大;当减小压强,C的体积分数减小。
(1)用“>”、“=”或“<”填空:该反应的ΔH______0,m+n______p。
(2)用“增大”“减小”或“不变”填空(其他条件不变):恒容下加入B,则A的转化率________;升高温度,则平衡时B、C的浓度之比c(B)/c(C)将________;加入催化剂,平衡时气体混合物的总物质的量________。
(3)若A、C均为无色气体,B为红色气体,用“变深”、“变浅”或“不变”填空:恒容下加入C,平衡混合物的颜色________;而恒压充入氖气,平衡混合物颜色________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】想一想:Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)这些物质为什么归为一类,下列哪些物质还可以和它们归为一类
A.75%的酒精溶液
B.硝酸钾
C.Al(OH)3胶体
D.牛奶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列保存物质或试剂的方法不正确的是
A.实验室保存溴时,常在保存液溴的试剂瓶中加入少量水来防止溴挥发
B.盛放溴水的试剂瓶不能用橡胶塞
C.新制氯水应密封保存在棕色试剂瓶中
D.取碘水于试管中,加入CCl4,振荡后静置,溶液分层,上层呈紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子晶体熔点的高低决定于阴、阳离子之间距离、晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是( )
A. KCl>NaCl>BaO>CaO B. NaCl>KCl>CaO>BaO
C. CaO>BaO>KCl>NaCl D. CaO>BaO>NaCl>KCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com