
 某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在1L密闭容器中,A、B、C三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:分析 (1)由图可知,2min末达到平衡状态,说明该反应为可逆反应,根据物质的量变化之比等于化学计量数之比确定化学计量数;
(2)反应物所具有的总能量大于生成物所具有的总能量,为放热反应;
(3)反应开始至2min末,A的物质的量减少了2mol,带入v=$\frac{△n}{V•△t}$计算;
(4)①根据盖斯定律,将所给的反应经加减乘除等变形得所要求的反应,反应热也做相应的变形即可;
②CO2与CS2属于等电子体,二者结构相似,CO2的结构式为O=C=O.
解答 解:(1)由图可知,2min末达到平衡状态,说明该反应为可逆反应,从反应开始到2min末,A的物质的量减少2mol、B的物质的量减少1mol,C的物质的量增加2mol,
因此该反应的化学方程式为2A+B?2C,
故答案为:2A+B?2C;
(2)反应物所具有的总能量大于生成物所具有的总能量,为放热反应,△H<0,
故答案为:小于;
(3)反应开始至2min末,A的物质的量减少了2mol,v(A)=$\frac{2mol}{1L×2min}$=1mol/(L•min),
故答案为:1mol/(L•min);
(4)①已知:a:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ•mol-1
b:S(s)+O2(g)=SO2(g)△H=-296.0KJ•mol-1
将方程式a×2-b得2CO(g)+SO2(g)=S(s)+2CO2(g)△H=(-283.0KJ•mol-1)×2-(-296.0KJ•mol-1)=-270KJ•mol-1,
热化学反应方程式为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270KJ•mol-1,
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270KJ•mol-1;
②CO2与CS2属于等电子体,二者结构相似,CO2的结构式为O=C=O,则CS2的结构式为S=C=S,
故答案为:S=C=S.
点评 本题考查较为综合,涉及化学平衡状态建立的过程和化学反应速率的计算、盖斯定律、等电子体等知识,题目难度中等,(1)注意2min时达到化学平衡状态,说明该反应是可逆反应,化学方程式中要写可逆号.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题
 .
.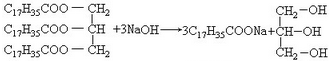 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | 任何元素的原子都是由核外电子和核内中子、质子组成 | |
| D. | ${\;}_{17}^{35}Cl$与${\;}_{17}^{37}Cl$得电子能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 | |
| B. | NaCl的电子式: | |
| C. | F+的结构示意图: | |
| D. | Fe3+的最外层电子排布式为3s23p63d5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| B. | 同系物的化学性质相似,物理性质随碳原子数的递增呈现规律性变化 | |
| C. | 两个相邻同系物的相对分子质量数值一定相差14 | |
| D. | 分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
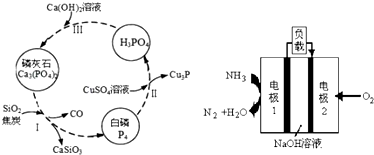
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和浓盐酸在空气中敞口放置时浓度均减少 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀H2SO4与锌反应时均能产生气体 | |
| D. | H2S、HI气体均不能用浓H2SO4制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为: I1=578kJ•mol-1 I2=1 817kJ•mol-1 I3=2 745kJ•mol-1 I4=11 575kJ•mol-1 I5=14 830kJ•mol-1 I6=18 376kJ•mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表中的第11列 |
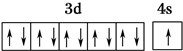 ,R在周期表中位于ds区.
,R在周期表中位于ds区.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com