
 化合物A的分子式为C3H6O2,B能发生银镜反应,有图示的转化关系,
化合物A的分子式为C3H6O2,B能发生银镜反应,有图示的转化关系, CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O, CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
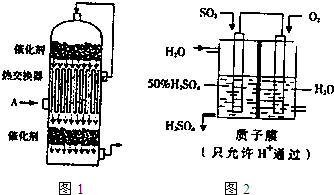
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| t/s | 0 | 500 | 1000 |
| C(NcOs)mol?L2 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 丁子香酚可用于制作杀虫剂和防腐剂,其结构简式如图所示.
丁子香酚可用于制作杀虫剂和防腐剂,其结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成物的质量分数一定增加 |
| B、生成物的物质的量一定增加 |
| C、反应物的转化率一定增加 |
| D、反应物的浓度不一定降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com