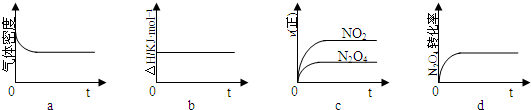【答案】
分析:(1)依据化学反应前后元素化合价变化分析判断,元素化合价降低的物质做氧化剂;
(2)二氧化氮是红棕色气体,四氧化二氮气体是无色气体,依据平衡移动原理分析判断;升高温度,平衡向吸热反应方向移动;
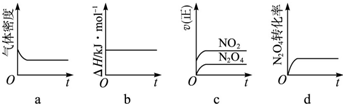
(3)K=
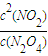
;化学平衡常数只与温度有关,与物质的浓度无关,根据v=
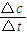
计算NO
2的化学反应速率,再根据同一反应中、同一时间段内反应速率之比等于计量数之比计算,得到四氧化二氮的反应速率v(N
2O
4);
(4)依据铵根离子水解分析回答;依据同粒子效应,一水合氨对铵根离子水解起到抑制作用;依据一水合氨的电离平衡常数计算得到氨水浓度.
解答:解:(1)反应(I)中,N
2O
4(l)中N元素得电子化合价降低,所以N
2O
4(l)是氧化剂,故答案为:氧化剂;
(2)升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应,故答案为:吸热;
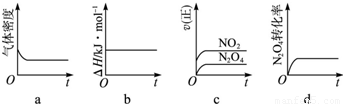
(3)一定温度下,反应(Ⅱ)的焓变为△H.现将1mol N
2O
4充入一恒压密闭容器中;
a、密度等于质量除以体积,平衡体系质量不变,反应体积增大,密度在反应过程中不变,说明反应达到平衡,故a符合;
b、反应的焓变和反应物与生成物能量总和之差计算,与平衡无关,故b不符合;
c、图象制表示正反应速率变化,不能证明正逆反应速率相同,故c不符合;
d、N
2O
4(l)转化率不变,证明反应达到平衡,故d符合;
示意图正确且能说明反应达到平衡状态的是ad;K=
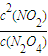
,化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变;v(NO
2)=
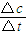
=
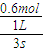
=0.2mol/L.s,则v(N
2O
4)=

v(NO
2)=0.1mol/L.s;
故答案为:ad;不变;0.1;
(4)NO
2可用氨水吸收生成NH
4NO
3.25℃时,将a mol NH
4NO
3溶于水,溶液显酸性,是因为铵根离子水解;反应的离子方程式为:NH
4++H
2O?NH
3?H
2O+H
+;加入氨水溶液抑制铵根离子水解,平衡逆向进行;将a mol NH
4NO
3溶于水,向该溶液滴加b L 氨水后溶液呈中性,溶液中氢氧根离子浓度=10
-7mol/L;NH
3?H
2O的电离平衡常数取K
b=2×10
-5 mol?L
-1,设混合后溶液体积为1L,根据一水合氨电离平衡得到:NH
3?H
2O?NH
4++OH
-,平衡常数K=
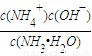
=
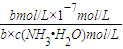
=2×10
-5 mol?L
-1,计算得到c(NH
3?H
2O)=
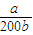
mol/L,
故答案为:NH
4++H
2O?NH
3?H
2O+H
+;逆向;
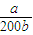
.
点评:本题考查了氧化还原反应的概念判断,化学平衡的影响因素分析,平衡标志的判断理解,平衡常数的影响因素和计算应用,化学反应速率的计算分析,弱电解质溶液中的电离平衡的计算应用,综合性较大.

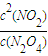 ;化学平衡常数只与温度有关,与物质的浓度无关,根据v=
;化学平衡常数只与温度有关,与物质的浓度无关,根据v=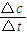 计算NO2的化学反应速率,再根据同一反应中、同一时间段内反应速率之比等于计量数之比计算,得到四氧化二氮的反应速率v(N2O4);
计算NO2的化学反应速率,再根据同一反应中、同一时间段内反应速率之比等于计量数之比计算,得到四氧化二氮的反应速率v(N2O4);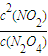 ,化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变;v(NO2)=
,化学平衡常数只与温度有关,与物质的浓度无关,所以平衡常数K不变;v(NO2)=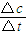 =
=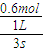 =0.2mol/L.s,则v(N2O4)=
=0.2mol/L.s,则v(N2O4)= v(NO2)=0.1mol/L.s;
v(NO2)=0.1mol/L.s;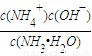 =
=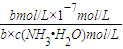 =2×10-5 mol?L-1,计算得到c(NH3?H2O)=
=2×10-5 mol?L-1,计算得到c(NH3?H2O)=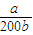 mol/L,
mol/L,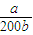 .
.