
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析 (1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积除以反应物的浓度系数次幂之积,固体、纯液体不需要在化学平衡常数中写出;
(2)已知:①C(s)+CO2(g)?2CO(g)
②CO(g)+H2O(g)?H2(g)+CO2(g)
③C(s)+H2O(g)?CO(g)+H2(g)
①+②可得③,则反应③的焓变①与②的焓变之和;
(3)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动;
设平衡时CO浓度变化量为xmol/L,表示出平衡时各组分浓度,根据平衡常数列方程计算解答;
(4)N2O4(g)═2NO2(g)△H>0,该反应为吸热反应,升高温度,化学平衡正向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小.
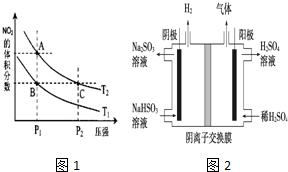
A.A、C两点在等温线上,压强越大,反应速率越快;
B.增大压强平衡向逆反应进行,向逆反应进行是减小由于压强增大导致浓度增大趋势,但到达平衡仍比原平衡浓度大;
C.B、C两点相同物质的含量相同,即二氧化氮与四氧化二氮的物质的量之比相等;
D.压强相同,升高温度,化学平衡正向移动,NO2的体积分数增大;
E.A、C两点温度相等,则平衡常数相同;
(5)(5)电解NaHSO3溶液制取H2SO4,阴极是氢离子放电,由于含氧酸根的还原性比氢氧根离子若,因此阳极是氢氧根离子放电,亚硫酸根通过离子交换膜进入右侧,被氧化为硫酸,分亚硫酸氢根离子会和氢离子反应生成二氧化硫气体.
解答 解:(1)反应为:C(s)+H2O(g)?CO(g)+H2(g)的平衡表达式K=$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$,
故答案为:$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$;
(2)已知:①C(s)+CO2(g)?2CO(g)
②CO(g)+H2O(g)?H2(g)+CO2(g)
③C(s)+H2O(g)?CO(g)+H2(g)
根据盖斯定律,①+②可得③,则△H1+△H2=△H3,
故答案为:△H1+△H2=△H3;
(3)由表中数据可知,随温度升高平衡常数减小,说明升高温度平衡逆向移动,则正反应为放热反应;
设平衡时CO浓度变化量为xmol/L,则:
CO(g)+H2O(g)?H2(g)+CO2(g)
开始(mol/L):0.02 0.02 0 0
变化(mol/L):x x x x
平衡(mol/L):0.02-x 0.02-x x x
所以$\frac{x×x}{(0.02-x)×(0.02-x)}$=9,解得x=0.015,
所以CO的转化率为$\frac{0.015mol/L}{0.02mol/L}$×100%=75%,
故答案为:放热;75%;
(3)A.由图象可知,A、C两点在等温线上,C的压强大,则A、C两点的反应速率:A<C,故A错误;
B.A、C两点都在等温线上,C的压强大,与A相比C点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比A的浓度高,NO2为红棕色气体,则A、C两点气体的颜色:A浅,C深,故B错误;
C.B、C两点相同物质的含量相同,即二氧化氮与四氧化二氮的物质的量之比相等,则平均相对分子质量相等,故C错误;
D.升高温度,化学平衡正向移动,NO2的体积分数增大,由图象可知,A点NO2的体积分数大,则T1<T2,由状态B到状态A,可以用加热的方法,故D正确;
E.A、C两点温度相等,则平衡常数相同,故E错误,
故选:D;
(5)电解NaHSO3溶液制取H2SO4,阴极是氢离子放电,由于含氧酸根的还原性比氢氧根离子若,因此阳极是氢氧根离子放电,亚硫酸根通过离子交换膜进入右侧,被氧化为硫酸,分亚硫酸氢根离子会和氢离子反应生成二氧化硫气体,阳极电极反应式为:4OH--4e-=2H2O+O2,
故答案为:4OH--4e-=2H2O+O2↑.
点评 本题考查化学平衡计算、化学平衡图象、平衡常数、反应热计算、电解原理等,是对学生综合能力的考查,难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②④⑤ | C. | ①③⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度(mol/L)相同的稀硫酸和NaHSO4 溶液中,前者中的SO42-浓度大 | |
| B. | pH相同,体积相同的NaHSO4和H2SO4溶液和足量的锌反应,后者放出氢气的量多 | |
| C. | 浓度相同,体积相同的盐酸和硫酸和足量的锌反应,放出氢气量相同 | |
| D. | 体积相同,pH相同的盐酸和硫酸分别与铝片反应,反应过程中速率不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.50 mol/L | B. | 0.40 mol/L | C. | 0.30 mol/L | D. | 0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈中性的盐一定是强酸、强碱生成的盐 | |
| B. | 含有弱酸根盐的水溶液一定呈碱性 | |
| C. | 盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱 | |
| D. | 强酸强碱盐的水溶液一定呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com