
| A. | 强酸跟强碱反应放出的热量一定是中和热 | |
| B. | 1 mol酸与1 mol碱完全反应放出的热量是中和热 | |
| C. | 在稀溶液中,强酸与强碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热 | |
| D. | 表示中和热的离子方程式为H++OH-═H2O△H=-57.3 kJ/mol |
分析 中和热是指酸和碱的稀溶液中和,生成1mol水时放出的热量,可以是强酸强碱,也可以是弱酸弱碱,只有是强酸强碱的稀溶液中和热才是57.5KJ/mol,据此分析.
解答 解:A、中和热是酸碱中和生成1mol水放出的热量,弱酸、弱碱的电离吸热,所测中和热小于强酸、强碱反应的中和热,酸碱的强弱不同,中和热的数值不等,故A错误;
B、中和热是生成1mol水时放出的热量,1mol硫酸与1mol氢氧化钡反应放出的热量就不是中和热,故B错误;
C、中和热的概念是指强酸与强碱的稀溶液中和,生成1mol水时放出的热量,故C正确;
D、强酸、强碱的稀溶液完全反应生成1mol水时放出的热量为57.3KJ,弱酸弱碱的中和热比57.3少,故D错误;
故选C.
点评 本题考查了中和热的相关问题,注意从中和热的概念出发分析即可,题目难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 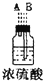 | 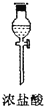 |  | 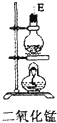 | 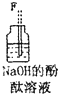 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4?Ba2++SO42- | B. | 2H2O?H3O++OH- | ||
| C. | NaHCO3═Na++H++CO32- | D. | NH3•H2O═NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中的粒子一定不带电,胶体中的分散质粒子带电荷 | |
| B. | 电泳现象证明胶体带电荷 | |
| C. | 加入电解质,胶体可产生沉淀,而溶液不能 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现光亮的通路,前者则没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管下端连有橡皮管的为酸式滴定管 | |
| B. | 在滴定时,左手操作锥形瓶,右手操作滴定管开关 | |
| C. | 滴定前应首先排除尖嘴部分的气泡 | |
| D. | 滴定过程中两眼应注视滴定管内液面的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com