
科目:高中化学 来源: 题型:
氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ), Mn(Ⅱ), Ni(Ⅱ)等杂质)的流程如下:
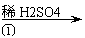 | 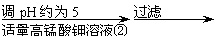 | 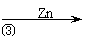 |
工业ZnO 浸出液 滤液
 | |||||
 | |||||
 | |||||
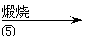
滤液 滤饼 ZnO
提示:在本实脸条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为 ;
加高锰酸钾溶液前,若pH较低,对除杂的影响是 ;
(2)反应③的反应类型为 。过滤得到的滤渣中,除了过量的锌外还有 ;
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是
。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2 .取干操后的滤饼11.2g,煅烧后可得到产品8.1 g. 则x等于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
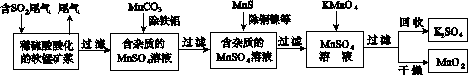
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中的Al3+和Fe3+,其原因是________________________________。
(3)已知:25 ℃、101 kPa时,
Mn(s)+O2(g)===MnO2(s) ΔH=-520 kJ/mol
S(s)+O2(g)===SO2(g) ΔH=-297 kJ/mol
Mn(s)+S(s)+2O2(g)===MnSO4(s)
ΔH=-1065 kJ/mol
SO2与MnO2反应生成无水MnSO4的热化方程式是____________________________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是________________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________________。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
中华人民共和国国家标准(CB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图(a)装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
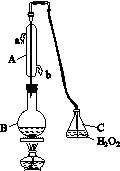
(a)
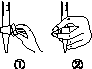
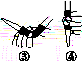
(b)
(1)仪器A的名称是__________________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中的H2O2完全反应,其化学方程式为________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图(b)中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________ g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O ,反应结束后锌没有剩余,则反应中被还原的硝酸与未被还原的硝酸的物质的量之比为 ( )
A.1:4 B.1:5 C.2:3 D.2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列现象中硫酸所表现出来的性质填写在空白处
(1)把锌粒放入稀硫酸中时,有气体放出。
(2)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加。
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑。
(4)木炭放入热的浓硫酸中时,有气体放出。
(5)常温下可以用铁或铝的容器贮存浓硫酸
(6)热的浓硫酸与铜片等金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
含Cr2O72﹣的工业酸性废水会造成铬污染,排放前要进行如下处理:(Ⅰ)往工业废水中加入适量的NaCl搅拌均匀;(Ⅱ)以Fe做两电极进行电解,从而使溶液的pH不断升高,废水由酸性转化为碱性,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生:(Ⅲ)过滤回收沉淀,废水达到排放标准.
(1)在电解过程中,溶液pH不断升高的原因可能是
①电解时废水的体积不断减小 ②电解时H+在阴极被还原 ③作为阳极的Fe不断溶解 ④Cr2O72﹣转化为Cr3+时消耗了H+ ⑤NaCl在电解时转化成了NaOH
A.⑤B.②④C.②③④D.①②③④
(2)两极发生反应的电极反应式为
阳极: ;阴极: .
(3)写出Cr2O72﹣变成Cr3+的离子方程式 .
(4) (填“能”或“不能”)改用石墨电极进行电解.
查看答案和解析>>
科目:高中化学 来源: 题型:
今有如下三个热化学方程式:
H2(g)+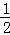 O2(g)═H2O(g)△H=a kJ•mol﹣1
O2(g)═H2O(g)△H=a kJ•mol﹣1
H2(g)+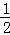 O2(g)═H2O(l)△H=b kJ•mol﹣1
O2(g)═H2O(l)△H=b kJ•mol﹣1
2H2(g)+O2(g)═2H2O(l)△H=c kJ•mol﹣1
关于它们的下列表述正确的是( )
|
| A. | 它们都是吸热反应 | B. | a、b和c均为正值 |
|
| C. | a=b | D. | 2b=c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com