
A.用惰性电极电解饱和氯化钠溶液的总反应为:2Cl- + 2H+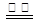 H2↑+ Cl2↑ H2↑+ Cl2↑ |
| B.锌铜原电池中盐桥中的阴离子移向ZnSO4溶液 |
| C.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| D.电镀时,镀层金属作阳极;精炼铜时,用纯铜作阴极 |
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源:不详 题型:单选题
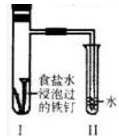
| A.过一段时间,Ⅱ试管中的导管内水柱上升 |
| B.Ⅰ试管中铁钉由于发生电解反应而被腐蚀 |
| C.铁钉在该试管中的腐蚀速度越来越快 |
| D.Ⅰ试管中铁钉发生反应的一个电极方程式为:2Cl—-2e—=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
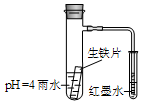
| A.生铁片中的碳是原电池的阳极,发生还原反应 |
| B.雨水酸性较强,生铁片仅发生析氢腐蚀 |
| C.墨水回升时,碳极反应式为:O2 + 2H2O + 4e—= 4OH— |
| D.具支试管中溶液pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③④ | C.①②③④ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
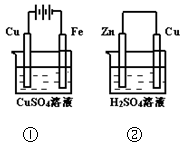
| A.在①中Cu棒为阳极;在②中Cu棒为负极 |
| B.电极上生成物质的质量:①<② |
| C.电极反应式:①中阳极:4OH一一4e一= 2H2O+O2↑;②中负极:2H+ + 2e一= H2↑ |
| D.溶液的pH:①不变;②增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

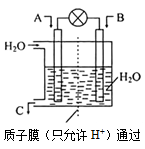
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.(a)区腐蚀比(b)区腐蚀严重 |
| B.该过程发生了化学反应:4Fe+3O2→2Fe2O3 |
| C.该过程是析氢腐蚀,负极反应为:Fe-2e →Fe2+ |
| D.该过程为吸氧腐蚀,正极反应为:O2+2H2O+4e→4OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 该电池的负极反应式为 。
该电池的负极反应式为 。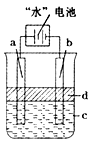
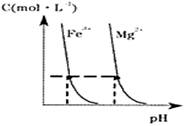
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com