
| 元素代号 | X | Y | Z | M | N | P |
| 原子半径/nm | 0.186 | 0.143 | 0.075 | 0.074 | 0.152 | 0.099 |
| 元素的主要化合价 | +1 | +3 | +5、-3 | -2 | +1 | +7、-1 |
| A、X、N元素的金属性:X>N |
| B、Y、M元素形成的离子化合物是工业冶炼Y的原料 |
| C、X单质在M单质中燃烧生成的化合物39g中共含有0.5NA个阴离子 |
| D、标准状况下1L 1mol?L-1的YP3溶液中含有NA个Y3+离子 |
| 39g |
| 78g/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
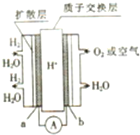 某质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极,下列手法中不正确的是( )
某质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极,下列手法中不正确的是( )| A、a极为该电池的负极 |
| B、该电池的正极反应式为O2+4e-+2H2O=4OH- |
| C、多孔活性铂电极有利于吸附气体,增大接触面积 |
| D、H+(质子)由负极移向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光导纤维是以硅酸盐为主要原料制成的 |
| B、硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第一位 |
| C、硅的化学性质不活泼,在自然界中可以以游离态存在 |
| D、硅在电子工业中,是最重要的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在即将到来的新能源时代,核能、太阳能、氢能将可能成为主要能源 |
| B、开发太阳能、氢能等新型能源有利于减少二氧化碳的排放量 |
| C、煤的气化技术是减少二氧化碳排放的重要措施 |
| D、煤的“气化”和“液化”技术可提高煤的综合利用效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2种 | B、3种 | C、4种 | D、5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,4.6g NO2气体约含有1.81×1023个原子 |
| B、在标准状况下,80g SO3所占的体积约为22.4L |
| C、常温下,0.1mol?L-1醋酸溶液的pH约为1 |
| D、标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯乙烯分子中所有原子可能在同一个平面上 |
| B、分子式为C7H8O且分子中有苯环有机物共有4种 |
| C、乙醇和甘油互为同系物 |
| D、除去乙醇中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com