
| A. | BaCl2 | B. | 溴水 | C. | 稀盐酸 | D. | 品红溶液 |
分析 碳酸钠、亚硫酸钠、硫酸钠中阳离子相同,阴离子不同,利用盐酸可鉴别,且溴水中含氢离子、溴单质,溴水与亚硫酸钠发生氧化还原反应,以此来解答.
解答 解:A.均与氯化钡反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.溴水与碳酸钠反应生成气体,溴水与亚硫酸钠发生氧化还原反应溴水褪色,溴水与硫酸钠不反应,现象不同,可鉴别,故B正确;
C.碳酸钠、亚硫酸钠、硫酸钠分别与盐酸混合的现象为:无色无味的气体、无色具有刺激性气体、无现象,现象不同,可鉴别,故C正确;
D.均与品红不反应,现象相同,不能鉴别,故D错误;
故选BC.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应及现象是解答本题的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下:
苯甲酸广泛用于医药、食品、染料、化工等领域.以下是实验室制备苯甲酸的一种方法.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +2MnO2↓+KOH+H2O
+2MnO2↓+KOH+H2O +HCl→
+HCl→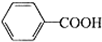 ↓+KCl
↓+KCl| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -96 | 不溶 | 易容 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 (100℃升华) | 25℃0.35g 80℃2.7g | 易容 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.
铁是最常见的金属材料.铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等多种配合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a/g | 起始读数/mL | b/mL | c/mL |
| 0.1970 | 0.00 | 31.30 | 42.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量 | |
| B. | 1个氢分子和1个碘分子完全反应需要吸收52kJ的热量 | |
| C. | 1mol H2(g)与1mol I2(g)完全反应生成2mol的HI(g)需吸收52kJ的热量 | |
| D. | 1mol H2(g)与1mol I2(g)完全反应放出26kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图1所示是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol•L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:
如图1所示是硫酸的试剂标签上的部分内容.某次学生实验需要0.5mol•L-1 H2SO4溶液480mL,若由你来配制所需溶液,请根据实验室已有的仪器和药品情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内颜色不随时间变化 | |
| B. | 容器内H2、Br2、HBr的浓度之比为1:1:2 | |
| C. | 容器内压强不随时间变化 | |
| D. | 单位时间内消耗n mol H2,同时消耗2n mol HBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com