
下列反应属于加成反应的是( )
A.C3H8+Cl2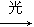 C3H7Cl+HCl
C3H7Cl+HCl
B.2FeCl2+Cl2=2FeCl3
C.CH2=CH2+H2O CH3CH2OH
CH3CH2OH
D.CH3CH2OH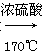 CH2=CH2↑+H2O
CH2=CH2↑+H2O
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:2014年高考化学苏教版总复习5-3微粒间相互作用力与物质多样性练习卷(解析版) 题型:填空题
Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y的原子序数小于Z。
(1)Q的最高价氧化物,其固态属于 晶体,俗名叫 ;
(2)R的氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式是 ;
(3)X的常见氢化物的空间构型是 ,它的另一氢化物X2H4是一种火箭燃料的成分,其电子式是 ;
(4)Q分别与Y、Z形成的共价化合物的化学式是 和 ,Q与Y形成的分子的电子式是 ,属于 分子 (填“极性”或“非极性”)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-3 人工合成有机化合物练习卷(解析版) 题型:选择题
CCTV《科技博览》报道,中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是( )
A.聚二氧化碳塑料是通过加聚反应制得的
B.聚二氧化碳塑料与干冰互为同素异形体
C.聚二氧化碳塑料与干冰都是纯净物
D.聚二氧化碳塑料的使用会产生白色污染
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-2 食品中的有机化合物练习卷(解析版) 题型:选择题
下列关于有机物的正确说法是( )
A.聚乙烯可发生加成反应
B.石油干馏可得到汽油、煤油等
C.淀粉、蛋白质完全水解的产物互为同分异构体
D.乙酸乙酯、油脂与NaOH溶液反应均有醇生成
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 9-1 化石燃料与有机化合物练习卷(解析版) 题型:选择题
环保型燃料—丙烷(C3H8)曾用于北京奥运会“祥云”火炬燃料,下列有关烷烃的说法不正确的是( )
A.丙烷分子中三个碳原子共平面
B.丁烷的一氯代物共有4种
C.正丁烷的4个碳原子在一直线上
D.CnH2n+2的烃中含有3n+1个共价键
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:填空题
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/ mol·L-1)如图所示。
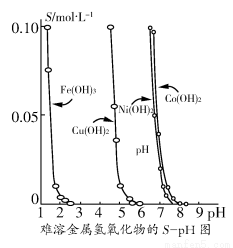
(1)pH=3时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是__________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________。
(5)已知一些难溶物的溶度积常数如下表:
物质 | FeS | MnS | CuS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 |
物质 | PbS | HgS | ZnS |
Ksp | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-4 难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知如下物质的溶度积常数:FeS,Ksp=6.3×10-18;CuS,Ksp=1.3×10-36;ZnS,Ksp=1.6×10-24。下列说法正确的是( )
A.同温度下,CuS的溶解度大于ZnS的溶解度
B.将足量CuSO4溶解在0.1 mol·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35mol·L-1
C.因为H2SO4是强酸,所以Cu2++H2S=CuS↓+2H+不能发生
D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
为了使FeCl3溶液中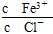 增大,可加入的物质是( )
增大,可加入的物质是( )
A.适量的HCl气体 B.适量的硫酸氢钠
C.适量的NaOH固体 D.适量的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:填空题
500℃时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,分析图像完成下列问题:
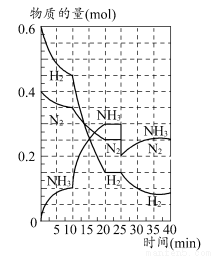
(1)0~10分钟,N2的平均反应速率为________mol·L-1·min-1,0~10分钟与10~20分钟两个时间段中,N2的反应速率之比为________。反应在第10 min可能改变的条件是________,运用图像信息说明该条件不是升温的原因:________。
(2)计算500℃时,反应N2+3H2 2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
(3)在上图中画出25~40 min时间段内N2的物质的量的变化图像。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com