
【题目】下列实验装置正确且能达到实验目的的是
A | B | C | D | |
实验目的 | 比较盐酸、碳酸、硅酸的酸性强弱 | 检验碳与浓H2SO4反应的产物中含CO2 | 验证铁的析氢腐蚀 | 模拟电解精炼铜 |
实验装置 |
|
|
|
|
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
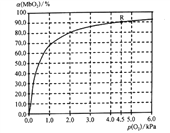
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基态原子的核外电子排布式为[Ar]3d104s1的元素在元素周期表中的位置是
A.p 区、第四周期第ⅠB 族B.ds 区、第四周期第Ⅷ族
C.d 区、第四周期第ⅠB 族D.ds 区、第四周期第ⅠB 族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)为白色或黄色结晶粉末或小结晶,其性质活泼,具有强还原性,是常用的食品抗氧化剂之一。制备该物质的反应方程式为: Na2SO3+SO2= Na2S2O5,某研究小组利用该反应在实验室制备焦亚硫酸钠并探究其有关性质。请回答下列问题:
(1)采用下图装置制取Na2S2O5,装置Ⅲ中有Na2S2O5晶体析出。
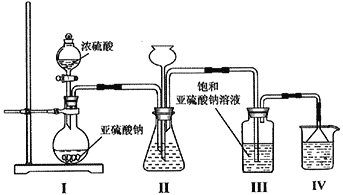
①装置Ⅰ中盛放浓硫酸的仪器名称为__________;滴加浓硫酸前需要将装置內的空气排净,这样操作的目的是___________________________________。
②装置Ⅱ的作用之一是观察SO2的生成速率,其中的液体最好选择____________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
③从装置Ⅲ中分离出Na2S2O5晶体可采取的操作方法是_______________;裝置Ⅳ的作用是_________________________,盛装的试剂为_____________________。
(2)将0.5mol Na2S2O5溶于水配成1L溶液,测得该溶液pH=4.5,溶液中部分微粒浓度随溶液酸碱性变化的情况如图所示。
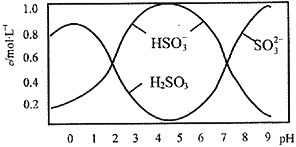
①写出上述条件下Na2S2O5溶解于水时与水反应的化学方程式_____________________;
②结合溶液中的离子平衡的知识解释溶液显酸性的原因_____________________________。
(3)检验Na2S2O5晶体在空气中已被氧化的实验方案是_________________________。
(4)葡萄酒常用Na2S2O5作抗氧化剂,葡萄酒中抗氧化剂的残留量通常是以游离SO2的含量计算,我国国家标准(GB2760—2014) 规定葡萄酒中SO2的残留量≤0.25g/L。该研究小组测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算) 的方案如下:
![]()
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
按上述方案进行实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量为___g·L-1,该数据说明某葡萄酒中SO2的残留量_________ (填“是”或“否”)达到我国国家标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向浓度均为0.1 molL-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH 固体,lg![]() 随加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是.
随加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是.
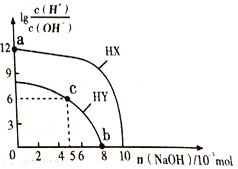
A. HX的酸性弱于HY
B. c点溶液中c(Y-)<c(HY)
C. a点由水电离出的c(H+)=10-12 molL-1
D. b点溶液中离子浓度大小关系为c(Y-)+c(HY)=c(Na+)+0.02 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在常温下,苯(C6H6)为一种无色、透明的液体,毒性较高,易挥发,易燃,有腐蚀性,沸点为80.1℃,难溶于水,易溶于有机溶剂,可作为有机溶剂;碘(I2)为紫黑色晶体,易升华,易凝华,熔点113.5℃,沸点184.3℃,加热时碘升华为紫色蒸气,冷却后凝华成紫黑色固体。实验室常用苯来提取碘水中的碘,具体操作如下:

①向碘的水溶液中加入萃取剂苯,转移到分液漏斗中,塞上玻璃塞,充分振荡放气后(如图1);
②将分液漏斗置于铁架台的铁圈上静置(如图2);
③当分液漏斗中的液体分成清晰的两层后,经“合适的操作”将两层液体进行分离;
④将分离出的碘和苯的混合液转移到仪器A中,加入少量沸石进行蒸馏以分离苯和碘(如图3)。
请回答下列问题:
(1)分液漏斗在使用前必须进行的操作是_______。
(2)步骤③中“合适的操作”的名称是________。
(3)步骤④中采用水浴加热而不直接加热的原因是________________;图3中有多处明显的错误:a.冷却水进出方向错误.b.___________________。
(4)锥形瓶置于冰水中的目的是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com