
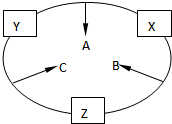
 原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个.
原子序数之和为16的三种短周期元素的单质X、Y、Z,常温常压下均为无色气体,在适当条件下X、Y、Z之间可以发生如右图所示的变化.已知B分子组成中Z原子个数比C分子中少一个. ,故答案为:
,故答案为: ;
; ,
, ;
;
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ | ||||
| B、石灰石与醋酸溶液反应:CaCO3+2H+=Ca2++H2O+CO2↑ | ||||
| C、溴化亚铁溶液中通入少量氯气:2Br-+Cl2=Br2+2C1- | ||||
D、NH4HCO3溶液中加入足量的NaOH溶液:NH+4+OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| O3,Zn/H2O |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3 | B、5 | C、7 | D、9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中逐渐滴入NaOH溶液至过量:Al3++4OH-=AlO2-+2H2O |
| B、将碳酸钙加入过量盐酸中:CO32-+2H+=CO2↑+H2O |
| C、向氯化铁溶液中加入铁粉:2Fe3++Fe=3Fe2+ |
| D、在CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的溶液:Fe3+、NH4+、Cl-、NO3- |
| B、pH=2的溶液:Fe2+、Al3+、Cl-、NO3- |
| C、能使甲基橙显黄色的溶液:Cl-、CO32-、K+、AlO2- |
| D、与铝反应产生大量氢气的溶液:[Ag(NH3)2]+、Na+、CH3COO-、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸 溶液 |
MnSO4固体 | 0.10mol/L KMnO4溶液 |
褪色 时间 |
| 1 | 650C | ---- | --- | 1mL | 1OOs |
| 2 | 650C | 10滴 | --- | 1mL | 90s |
| 3 | 750C | 10滴 | ---- | 1mL | 40s |
| 4 | 750C | 10滴 | 加入少许 | 1mL | 3s |
| 实验步骤 | 预期现象和结论 |
| 将很少量Cl2通入过量的FeI2溶液中; 取少量反应后溶液分置于A、B两试管中;往A中滴加 往往B中滴加 |
若 则假设1成立; 若 则假设2成立. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com