
| A. | 化学反应中,物质变化的同时不一定发生能量变化 | |
| B. | 反应焓变(△H)的大小与方程式中各物质的化学计量系数无关 | |
| C. | 反应产物的总焓大于反应物的总焓时,反应吸热,△H>0 | |
| D. | 吸热反应中,形成化学键释放的能量大于断裂化学键吸收的能量 |
分析 A.化学反应中一定有化学键的断裂和生成,则一定有能量变化;
B.焓变与化学方程式的书写有关;
C.△H>0的反应为吸热反应;
D.焓变等于断裂吸收的能量减去形成化学键释放的能量.
解答 解:A.化学反应中一定有化学键的断裂和生成,断键吸收能量,成键释放能量,则物质变化的同时一定发生能量变化,故A错误;
B.焓变与化学方程式的书写有关,则反应焓变(△H)的大小与方程式中各物质的化学计量系数有关,故B错误;
C.△H>0的反应为吸热反应,则反应产物的总焓大于反应物的总焓时,反应吸热,故C正确;
D.焓变等于断裂吸收的能量减去形成化学键释放的能量,则吸热反应中,形成化学键释放的能量小于断裂化学键吸收的能量,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、焓变与键能的关系为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的易错点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1 $→_{键断裂}^{498J/mol}$
$→_{键断裂}^{498J/mol}$ +
+
 $→_{键断裂}^{946kJ/mol}$
$→_{键断裂}^{946kJ/mol}$ +
+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
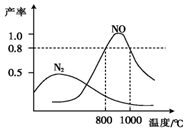 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:
氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:| A. | v(N2)=v(NO) | |
| B. | 反应①的焓变△H保持恒定 | |
| C. | 体系的密度不再发生变化 | |
| D. | 混合气体的平均相对分子质量不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴离子的还原性:X<Y<Z | B. | 单质的氧化性:X>Y>Z | ||
| C. | 酸性:H3ZO4>H2YO4>HXO4 | D. | 气态氢化物的稳定性:X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 河流三角洲的形成与胶体的性质无关 | |
| B. | 清晨在密林中看到的一缕缕光束,是丁达尔现象的表现 | |
| C. | 向沸水中逐滴加入FeCl3溶液并加热至液体呈透明的红褐色,可得氢氧化铁胶体 | |
| D. | 胶体粒子的直径大小在1~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄淸石灰水,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入KSCN溶液无明显现象,再加入新制氯水溶液变为血红色,一定有Fe2+ | |
| D. | 加入过量硝酸银溶液,产生白色沉淀,再加入稀盐酸沉淀不溶解,则一定含有C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,0.1 mol/LHX溶液中pH=1 | |
| B. | Ksp(CaX2)随温度和浓度的变化而变化 | |
| C. | 该体系中,c(Cl-)=c(Ca2+) | |
| D. | 该体系中HX与CaCl2反应产生沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com