
��������Ҫ�Ļ�����Ʒ���ڻ�����ѧʵ���У�������Ҫ�����á�
��1�����ʵ���Ũ��Ϊ18��4mol/L,��������Ϊ0��98��Ũ��������ˮ����ʱ���������������½���0��87���ܶ�1��8g?cm-3������ʱ����ʧȥ���������� ��������Ϊ0��87����������ʵ���Ũ��Ϊ
��������λС������ͬ����50mL 18��4mol/L��Ũ������Ϊ�����ʱ��������ˮ___________g��
��2����ҵ���Ը����������ᣮ����Ϊԭ����ȡ�����[NH4Al(SO4)2��12H2O]������������Ӧԭ�����£����Ը����������ɷ�������ķ�Ӧ����
Al2O3 + 3H2SO4 �� Al2(SO4)3 + 3H2O����������
Al2(SO4)3 + H2SO4 + 2NH3 �� 2NH4Al(SO4)2����������
ij������ͬʱ��ȡ���������������ͨ����������������������ֲ�Ʒ�IJ���������ʹ�Ƶõ�������������������ʵ���֮��Ϊ1:1����Ͷ��ʱ����������������ʵ���֮����
��3�����Ṥҵ�ϴ���ýӴ��������ᣨ��������������������Ϊ20%����Ϊʹ���������ճ�֣���ͨ�����40%�Ŀ����������պ�¯����SO2���������Ϊ_____��
��4��������¯��������������ֱ������Ӵ��ң��������������5%��ͬ��ͬѹ�²ⶨ�����Լ���SO2��ת����
��1��(4��)15��98 mol��L-1 11��63 ��2��(2��) 3��10
��3��(3��) 0��11 ��4��(3��) 93%��
���������������1��C=n/v=1��8*0��87*1000/98*1=15��98 ��mol��L-1 ��
�⣺��������ˮ������Ϊx �������ʵ���������
18��4*50*0��98=(x+18��4*50)*0��87 x=116��3
��2���⣺��������������������ʵ���Ϊx
Al2O3 + 3H2SO4 �� Al2(SO4)3 + 3H2O����������
3/2 x 9x/2 3/2 x
Al2(SO4)3 + H2SO4 + 2NH3 �� 2NH4Al(SO4)2����������
1 1 2
x/2 x/2 x
����������������ʵ���֮����: 3/2 x:( 9x/2+ x/2)= 3��10
��3���⣺����������Ϊa
4FeS2+11O2=2Fe2O3+8SO2
11 8
a*20% 0��145a
SO2���������Ϊ��0��145a *100%/��1+40%��a*80%+ 0��145a =0��108 a ����Ϊ0��11 a
��4��2SO2+ O2="2" SO3 �SV
2 1 1
10%a 5%a
SO2��ת����Ϊ��10%a*100%/0��108 a=93%
���㣺�����Թ�ҵ����Ϊ���������黯ѧ�����֪ʶ��


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�ҹ��Ǹ��������,���������������һλ,��¯��������Ϊ�ձ������������ij�ֿ�ʯ����Ԫ����������FemOn����ʽ����,�ֽ�������ʵ��:����������ʯ��Ʒ����,��ȡ25.0 g��Ʒ���ձ���,����ϡ�������ܽ�,�����ϼ��ȡ�����,��ȥ�������������Һ�м���10.0 gͭ�۳�ַ�Ӧ����ˡ�ϴ�ӡ������ʣ�����3.6 g��ʣ����Һ��2 mol��L-1������KMnO4�ζ�,���յ�ʱ����KMnO4��Һ���25.0 mL��
(1)���������ʯ����Ԫ�ص�����������
(2)����������FemOn�Ļ�ѧʽ(m��nΪ������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
6.5gп��100mL2mol/Lϡ������ȫ��Ӧ����Ӧ����Һ�������Ϊ100mL����
��1���ڱ�״���£���������������
��2������������ʵ���Ũ�ȣ�
��3����Ӧ�����Һ��SO �����ʵ���Ũ�ȣ�
�����ʵ���Ũ�ȣ�
��4���ڷ�Ӧ�����Һ�м���1mol/L����������Һ��ǡ��ʹ���еĽ���������ȫ����ʱ�����������������Һ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�����������ֽ�����ĩA��B�ֱ���ͬŨ�ȵ�����ϡ���ᷴӦ��������+2�۽����Ȼ���䷴Ӧ�����ͼ��ʾ��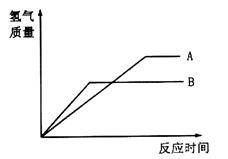
��1����Fe��Zn��Cu��A��__________��B��____________��
��2�������ֽ�����ĩ��һ��������Ϻ��мס��ҡ�������ʵ�飬����ʵ���ȡ500mLͬŨ�ȵ����������ֻ�Ϸ�ĩ���й��������£�
| ʵ����� | �� | �� | �� |
| ��Ϸ�ĩ����/g | 6��2 | 18��6 | 24��8 |
| ���������������״���£�/mL | 2240 | 5600 | 5600 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��ij���۽����������ij���۽���������ĵ����ʵ�����ɵĻ����,����������Ϊ28:51��ȡ���ֻ����19.75g��ǡ������166mLŨ��Ϊ20%���ܶ�Ϊ1.10g/cm3�����ᷴӦ�����������ֽ��������ԭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��ͼװ���У��������ڳ���0.1 mol NO���壬�������װ��һ����Na2O2����A������ͨ��CO2���壮�����£��������л���������D�����ƶ���������C��ʱ���������С����С��Ϊԭ����� ������CO2�ļ���ͨ�룬�������������ƶ����������ǻ�����ĥ����
������CO2�ļ���ͨ�룬�������������ƶ����������ǻ�����ĥ����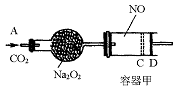
��֪�� 2Na2O2 + 2CO2 �� 2Na2CO3 + O2
��1����֪����������C��ʱ������������ʵ�����������2.24 g��
�ٴ�ʱ��ͨ���״���µ�CO2�������L��
����������NO2ת��ΪN2O4��ת�����Ƕ��٣�
�ۻ�������C������ͨ��a mol CO2����ʱ����ǡ�û���D������aֵ�� 0.01������ڡ�С�ڡ����ڣ����������� ��
��2�����ı�������Na2O2������Ҫͨ�����ڼ��������¶ȼ�ͨ�����CO2��ʹ����������D��C���ִ�C��D���ƶ�����Na2O2��������СֵӦ����________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
Ba2����һ���ؽ������ӣ���һ�������С��������Na2S2O3��KI��K2Cr2O7���Լ��ⶨij������ˮ��Ba2�������ʵ���Ũ�ȡ�
��1��������ƿ��ʹ�÷����У����в�������ȷ���ǣ�����ĸ��________��
| A��ʹ������ƿǰ������Ƿ�©ˮ |
| B������ƿ��ˮϴ�������ô�����Һ��ϴ |
| C��������Һʱ����������ǹ��壬�ѳƺõ�������ֽ��С�ĵ�������ƿ�У�������ˮ���ӽ�����1��2 cm�����õι���εμ�����ˮ������ |
| D��������Һʱ����������Һ�壬����Ͳ��ȡ������ֱ�ӵ�������ƿ�У�������ˮ���ӽ�����1��2 cm�����õι���εμ�����ˮ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
��1������ƿ�Ϻ����������еģ���д��ĸ��
A��ѹǿ B���¶� C���ݻ� D���ܶ� E���̶���
��2����Ũ��������250mL2mol?L-1������Һʱ������IJ����������ձ����������ͽ�ͷ�ι�֮�⣬����Ҫ �����������ƣ������������ƹ���ʾ��ͼ�У��д�����ǣ���д��ţ� ��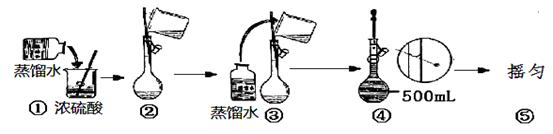
��3����Ҫ������ƿ����500mL0.4mol?L-1Na2CO3��Һ,��õ���Һ�����Լ�ƿ����Ҫ���ϱ�ǩ�������������ͼ��ǩ�ϵ���������ȥ��
��4�����������ʹ������Һ�����ʵ���Ũ��ƫ�͵��� ������ţ�
A.����ƿ������ˮϴ����,δ���������������
B.NaOH�ܽ�������������ƿ��
C.����ʱ,���ӿ̶���
D.ҡ�Ⱥ���Һ��δ���̶���,������ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵����ȷ����
| A������蘆��۵�ȵ���﮵ĸ� |
| B������Ľ�������ͨ����ֽ |
| C��Ԫ��N���⻯��ķе��Ԫ��P���⻯��ķе�� |
| D����пƬ����������Ƭ������������Ȼ�п��Һ����Ƭ�������һ��п |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com