
����Ŀ����ҵ����Ҫ����һ�����յĺ�ͭ�������쵨����CuSO45H2O�����÷����и��ֳɷݺ������£�Cu��CuOԼռ87%������ΪMg��Al��Fe��Si��������������������������ʣ���������Ϊ�� 
���ֽ���������������������ʽ��ȫ����ʱ��Һ��pH�����
������ | Al��OH��3 | Fe��OH��3 | Cu��OH��2 | Mg��OH��2 | Fe��OH��2 |
pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
��ش��������⣺
��1���������ΪʲôҪ����ͭ������ĥ�ɷ�״�� ��
��2��������е����ӷ���ʽ��д��2�����ɣ����� ��
��3���������H2O2�μӷ�Ӧ�����ӷ���ʽ�� ��
��4��������е�����ҺpHʱ���˵�������������ţ���
A��NaOH B����ˮ C��Cu2��OH��2CO3 D��Cu��OH��2 E��MgCO3
��5������������������pH=2��3��ԭ���� ��
��6�������ķ��뷽�������� ��
���𰸡�
��1��������巴Ӧ��ı����������ѧ��Ӧ������
��2��2Al+2OH��+2H2O=2AlO2��+3H2����Si+2OH��+H2O=SiO32��+2H2����Al2O3+2OH��=2AlO2��+H2O��SiO2+2OH��=SiO32��+H2O
��3��2Fe2++H2O2+2H+=2Fe3++2H2O
��4��C��D
��5������Cu2+��ˮ�⣬Ҳ������������
��6������Ũ������ȴ�ᾧ�����ˣ���ϴ�ӡ����
���������⣺��ͭ�������쵨����CuSO45H2O����Cu��CuOԼռ87%������ΪMg��Al��Fe��Si��������������������������ʣ������ӹ����ȼ���Һ��Al��Si��������������Ӧ����������ˮ�����˵õ�����ΪCu��Mg��Fe��������������������������ʣ�ˮϴ��PH=7����ϡ���ᡢ˫��ˮ��80�汣��0.5h��CuO��MgO��FeO������ϡ������������ͭ������þ������������ͭ���������ӱ�˫��ˮ������ͭ���Ӻ����������ӣ�����PH=5.2������1Сʱ�����������ӳ�����ȫ�����˵õ�����������������Һ����Һ�к���ͭ���Ӻ�þ���ӣ������������ҺpH=2��3����������Һ����Ũ������ȴ�ᾧ�����˵õ���Ʒ������Ũ��ʱ�ᵼ��Cu2+����ˮ������Cu��OH��2 �� ���������pH=2��3��Ϊ������Cu2+��ˮ�⣬Ҳ�����������ʣ���1����Ӧ��ĽӴ�����뷴Ӧ���ʳ����ȣ�����ͭ������ĥ�ɷ�״��������巴Ӧ��ĽӴ�������ӿ��˷�Ӧ���ʣ����Դ��ǣ�������巴Ӧ��ı����������ѧ��Ӧ�����ʣ���2�������輰���������������趼����Ӧ����Ӧ�����ӷ���ʽΪ��2Al+2OH��+2H2O=2AlO2��+3H2���� Si+2OH��+H2O=SiO32��+2H2����Al2O3+2OH��=2AlO2��+H2O�� SiO2+2OH��=SiO32��+H2O�����Դ��ǣ�2Al+2OH��+2H2O=2AlO2��+3H2���� Si+2OH��+H2O=SiO32��+2H2����Al2O3+2OH��=2AlO2��+H2O��SiO2+2OH��=SiO32��+H2O����3�������������ǿ�����ԣ����������������Ϊ�����ӣ���������ԭΪˮ�����ӷ���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O�����Դ��ǣ�2Fe2++H2O2+2H+=2Fe3++2H2O����3������pH���������µ����ʣ�A������������ӣ�B�������笠����ӡ�E�������þ���ӣ�C��D�����ʻ�������ӷ�Ӧ����pH��ͬʱ����ͭ���ӣ����������µ����ʣ����Դ��ǣ�C��D����4��ͭ����Ϊ������������ˮ�⣬ˮ�ⷽ��ʽΪ��Cu2++2H2OCu��OH��2+2H+ �� ����ʱ��ٽ�ˮ�⣬�������ᣬ������H+����Ũ�ȣ�������ͭ����ˮ�⣬���Դ��ǣ�����Cu2+��ˮ�⣬Ҳ�����������ʣ���5�������Ϊ����Һ�л������ͭ���壬����Һ�еõ�����һ���ȡ����Ũ������ȴ�ᾧ�����ˣ���ϴ�ӡ���� �ķ��������Դ��ǣ�����Ũ������ȴ�ᾧ�����ˣ���ϴ�ӡ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ���� �� ��
A.��״���£�2.24 L Cl2��������NaOH��Һ��Ӧ��ת�Ƶĵ�����ĿΪ0.1NA
B.��ӦNH3(g)+HCl(g)��NH4Cl(s)�������¿��Է����У���÷�Ӧ�Ħ�H��0
C.��ҵ����Ҫ��BaSO4����ת��ΪBaCO3 ������Ȼ����Ba2+ �� ������ΪKsp(BaSO4)��Ksp(BaCO3)��
D.��֪I ![]() I2��I�� �� ��ʢ��KI3��Һ���Թ��м�������CCl4 �� ���ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ�
I2��I�� �� ��ʢ��KI3��Һ���Թ��м�������CCl4 �� ���ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������У������Ӱ뾶�������Ӱ뾶��ֵ��С����
A. NaFB. NaClC. MgI2D. KBr
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC9H18O2���л���A�������������½�������ת����ͬ��ͬѹ�£���ͬ������B��C��������ռ�����ͬ��������˵������ȷ���ǣ� ����A��B��C��D��E��Ϊ�л�� 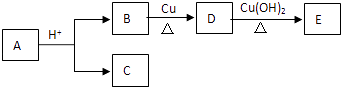
A.��������ת����ϵ���л���A�Ľṹ��8��
B.C��Eһ��Ϊͬϵ��
C.1molB��ȫת��ΪDת��2mol����
D.D��E����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ѳ�Ϊ���ͬ�ĺ��������д�ʩ�����ڱ����������ǣ� ��
A.�����ƹ�ʹ�����ͻ���װ�β���
B.��չ���ú��������չú���ۺ�����
C.���ƹ�ҵ��ˮ��������ˮ���ŷţ�����ˮ������
D.�ر��������մ�����������������ҵ����ȫ���͵�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��������C5H12�ѽ⣬�����Եõ�ϩ���������ǣ�������
A.3��B.4��C.5��D.6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ���ǣ� ��
A.MnO2 ��Ũ���ᷴӦ��Cl2��MnO2+4HCl ![]() Mn2++2Cl��+Cl2��+2H2O
Mn2++2Cl��+Cl2��+2H2O
B.��������ˮ����Al��OH��3���壺Al3++3H2O�TAl��OH��3��+3H+
C.Na2O2����ˮ����O2��Na2O2+H2O�T2Na++2OH��+O2��
D.Ca��HCO3��2��Һ������NaOH��Һ��Ӧ��HCO3��+Ca2++OH���TCaCO3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����ȡ����Ӧ����
A. �����ڿ�����ȼ��
B. ����Һ�巴Ӧ�����屽
C. ��һ����������ϩ�ƾ���ϩ
D. ��һ����������ϩ��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ҵ���������ײ�����ҵ�����ϡ���'���Ϊ����̽�������ǻ�ѧ����Ҫ��ɵģ�ij�����Ĺ��˷����к���ͭ�������������������Ʊ�CuSO45H2O��Fe SO47H2O��AlCl3������ͼ�� 
��1����AlCl3��Һ���ɲ����գ��õ��IJ����� ��
��2��д��A��C�Ļ�ѧ����ʽ�� ��
��3��������ҺD�еĽ��������ӵķ�����
��4��д��E��CuSO4�Ļ�ѧ����ʽ�� ��
��5��д���������ռӦ�����ӷ���ʽ�� ��
��6��ȡ������ҺD�������м���˫��ˮ������Ϊ�� ��
��7����CuSO4��Һ����ͭ�ľ���Һ�������Ϸ����ĵ缫��ӦʽΪ�� ��
��8���ƺ������ǻ��ý�����д�����������ƵĻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com