
| 实验步骤 | 有关问题 |
| ①计算所需KCl的质量 | 需要称量KCl的质量为 |
| ②称量KCl固体 | 称量需要用到的主要仪器是: |
| ③将KCl加入100ml烧杯中,并加入适量水 | |
| ④将烧杯中溶液转移至500ml容量瓶中 | |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处应如何操作: |


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器:
浙江省“五水共治”是水质治理的重要举措,其中化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度.COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量.某学习小组用重铬酸钾法测定某水样中的COD.主要的实验装置、仪器及具体操作步骤如下:实验装置及仪器: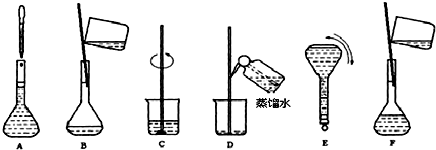
查看答案和解析>>
科目:高中化学 来源: 题型:
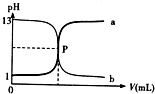
| A、P 点时反应恰好完全中和,溶液呈中性 |
| B、盐酸的物质的量浓度为1mol/L |
| C、曲线a是盐酸滴定氢氧化钠的滴定曲线 |
| D、酚酞不能用做本实验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.2×10-7 K2=5.6×10-11 |
| A、0.1mol?L-1NaHCO3溶液中浓度的大小:c(Na+)>c(HCO 3-)>c(H+)>c(OH-) |
| B、少量的CO2通入到NaCN溶液中 CN-+H2O+CO2=HCN+HCO 3- |
| C、用0.1mol?L-1NaOH溶液中和等浓度的HCN和HCOOH时前者所需NaOH溶液体积大 |
| D、0.1mol?L-1HCOONa溶液比0.1mol?L-1NaCN溶液所含离子总数小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先配制一定量的0.10mol?L-1氨水,然后测溶液的pH,若pH小于13,则可证明一水合氨为弱电解质. |
| B、先分别配制一定量0.01mol?L-1氨水和0.10mol?L-1氨水,分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明一水合氨是弱电解质. |
| C、先测0.10mol?L-1 氨水的pH,然后将其加热至100℃,再测pH,如果pH变大则可证明一水合氨是弱电解质. |
| D、配制一定量的NH4Cl溶液.测pH.若常温下pH小于7.则证明一水合氨是弱电解质. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com