
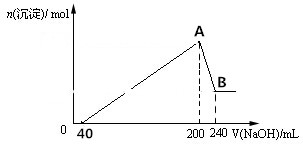
分析 由图象可知,从开始至加入40mLNaOH溶液没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时:n(Na2SO4)=$\frac{1}{2}$n(NaOH),则n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×5mol/L×0.2L=0.5mol,根据c=$\frac{n}{V}$计算出硫酸的浓度;
从200mL开始NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,溶解氢氧化铝消耗的氢氧化钠溶液体积为:240mL-200mL=40mL=0.04L,消耗氢氧化钠的物质的量为:5mol/L×0.04L=0.2mol,根据反应可知沉淀中氢氧化铝的物质的量为0.2mol;生成Mg(OH)2和Al(OH)3总共消耗(200-40)mL=160mL=0.16L氢氧化钠溶液,消耗氢氧化钠的物质的量为:5mol/L×0.16L=0.8mol,其中生成0.2mol氢氧化铝消耗了0.6mol氢氧化钠,则生成氢氧化镁消耗的氢氧化钠为:0.8mol-0.6mol=0.2mol,则氢氧化镁的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,再结合质量守恒计算出合金中Al、Mg的物质的量、质量.
解答 解:由图象可知,从开始至加入NaOH溶液40mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时:n(Na2SO4)=$\frac{1}{2}$n(NaOH),则n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×5mol/L×0.2L=0.5mol;
从200mL开始NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,溶解氢氧化铝消耗的氢氧化钠溶液体积为:240mL-200mL=40mL=0.04L,消耗氢氧化钠的物质的量为:5mol/L×0.04L=0.2mol,根据反应可知沉淀中氢氧化铝的物质的量为0.2mol;生成Mg(OH)2和Al(OH)3总共消耗(200-40)mL=160mL=0.16L氢氧化钠溶液,消耗NaOH的物质的量为:5mol/L×0.16L=0.8mol,其中生成0.2mol氢氧化铝消耗0.6mol氢氧化钠,则生成氢氧化镁消耗的氢氧化钠:0.8mol-0.6mol=0.2mol,故氢氧化镁的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,
(1)从开始至加入NaOH溶液40mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,离子反应为:H++OH-=H2O;
当加入NaOH溶液的体积大于200mL时,由图象可知,这是溶解Al(OH)3,离子反应为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:H++OH-=H2O;Al(OH)3+OH-=AlO2-+2H2O;
(2)根据分析可知,沉淀达到最大时生成了0.2molAl(OH)3,0.1molMg(OH)2,根据质量守恒可知,原合金中含有Al的物质的量为0.2mol;
含有金属Mg的物质的量为0.1mol,质量为:24g/mol×0.1mol=2.4g,
故答案为:0.2mol;2.4g;
(3)沉淀量最大时溶液中溶质为Na2SO4,根据钠元素守恒可知此时:n(Na2SO4)=$\frac{1}{2}$n(NaOH),则n(H2SO4)=n(Na2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×5mol/L×0.2L=0.5mol,加入的硫酸的浓度为:c(H2SO4)=$\frac{0.5mol}{0.25L}$=2mol/L,
故答案为:2mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确图象中曲线变化的含义为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸电离的热化学方程式为:HF(aq)?F-(aq)+H+(aq)△H=-10.4 kJ•mol-1 | |
| B. | 当V=20时,溶液中:c(OH-)=c(H+)+c(HF) | |
| C. | 当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol/L | |
| D. | 当V=20时,溶液中水的电离程度最大(忽略溶液温度的变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg12C含有约6.02×1023个碳原子 | |
| C. | 1个氧原子的实际质量约为$\frac{6.02×1{0}^{23}}{32}$g | |
| D. | 3molOH-的质量为51g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡是动态平衡 | |
| B. | 各反应物的浓度等于各生成物的浓度 | |
| C. | 正逆反应速率为零 | |
| D. | 反应物和生成物的浓度不再改变,反应已停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素相对原子质量依次递增 | |
| B. | 元素的最高正化合价呈周期性变化 | |
| C. | 元素原子最外层电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•L-1•min-1 | B. | v(B)=0.3mol•L-1•s-1 | ||
| C. | v(C)=0.1mol•L-1•s-1 | D. | v(D)=0.4mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠浮在液面上 | B. | 有无色无味的气体产生 | ||
| C. | 水溶液变为蓝色 | D. | 水溶液变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | W1 | W3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=1.5mol•L-1•min-1 | |
| B. | 2c1<1.5 | |
| C. | 2ρ1=ρ2 | |
| D. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}(3{c}_{1}-1.5)^{3}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com