
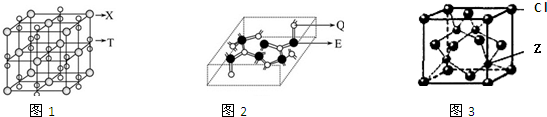
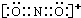 ,元素的非金属性越强,其第一电离能越大,非金属性O>N>C,但是由于N元素的p轨道处于半充满状态,相对稳定,故第一电离能大于O,故C、N、O的第一电离能大小顺序为:N>O>C,Z为Cu元素,原子序数为29,位于周期表第四周期第ⅠB族,电子排布式为 1s22s22p63s23p63d104s1,故答案为:
,元素的非金属性越强,其第一电离能越大,非金属性O>N>C,但是由于N元素的p轨道处于半充满状态,相对稳定,故第一电离能大于O,故C、N、O的第一电离能大小顺序为:N>O>C,Z为Cu元素,原子序数为29,位于周期表第四周期第ⅠB族,电子排布式为 1s22s22p63s23p63d104s1,故答案为: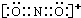 ; N>O>C;1s22s22p63s23p63d104s1;
; N>O>C;1s22s22p63s23p63d104s1;| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 8 |
| 1 |
| 2 |
| 99.5 |
| NA |
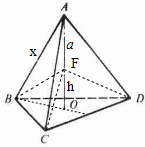 ,连接F与A、B、C、D,则三棱锥A-BCD均分为等4个等体积的三棱椎,则V三棱锥A-BCD=4V三棱锥F-BCD=,故
,连接F与A、B、C、D,则三棱锥A-BCD均分为等4个等体积的三棱椎,则V三棱锥A-BCD=4V三棱锥F-BCD=,故| 1 |
| 3 |
| 1 |
| 3 |
| 1 |
| 3 |
| ||
| 2 |
| 2 |
| 3 |
| ||
| 3 |
| ||
| 3 |
| 1 |
| 3 |
2
| ||
| 3 |
4
| ||
| 3 |
| 64 | ||
3
|
| 4×99.5 | ||||
NA?(
|
| 4×99.5 | ||||
NA?(
|


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、用分液漏斗分离乙醇和水 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用加热的方法分离氯化钠和硝酸钾固体 |
| D、用四氯化碳萃取碘的饱和水溶液中的碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
| 第三次 | 10.00 | 0.40 | 23.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、因浓硫酸具有强氧化性,故不可用它来干燥氢气 |
| B、浓硫酸与浓氨水靠近时产生大量白烟 |
| C、浓硫酸有强氧化性,稀硫酸不具有氧化性 |
| D、浓硫酸具有腐蚀性,取用时要小心 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com