
| A. | 反应中电能转化为化学能 | |
| B. | 反应低温可以自发转化 | |
| C. | 上述反应若使用催化剂,能改变反应的△H | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=74.8kJ•mol-1 |
分析 A.利用太阳光能制氢气,是光能转化为化学能;
B.反应为吸热反应,低温下不能进行;
C.催化剂不能改变反应热的大小;
D.根据盖斯定律,目标反应CH4(g)═C(s)+2 H2(g)相当于③-②.
解答 解:A.太阳光催化分解水制氢气,是光能转化为化学能,故A错误;
B.反应为吸热反应,低温下不能进行,故B错误;
C.催化剂不能改变反应热的大小,只能改变化学反应速率,故C错误;
D.根据盖斯定律,目标反应CH4(g)═C(s)+2 H2(g)相当于③-②,故△H=△H3-△H2,△H=206.1kJ•mol-1-131.3kJ•mol-1=74.8kJ•mol-1,故D正确.
故选D.
点评 本题考查了化学反应与能量变化,为高频考点,利用盖斯定律进行相关计算,注意催化剂不能改变焓变,盖斯定律计算时焓变的加减时正负号,为易错点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和食盐水除去Cl2中的HCl气体 | |
| B. | 用饱和碳酸氢钠溶液除去CO2中HCl气体 | |
| C. | 用Mg(OH)2除去MgCl2溶液中的少量FeCl3 | |
| D. | 用BaCl2溶液除去KNO3溶液中少量K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 2:3 | D. | 4:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于自来水的消毒 | |
| B. | 四氧化三铁常用作红色油漆和涂料 | |
| C. | 明矾可用于净水 | |
| D. | 过氧化钠用于呼吸面具和潜水艇里氧气的来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
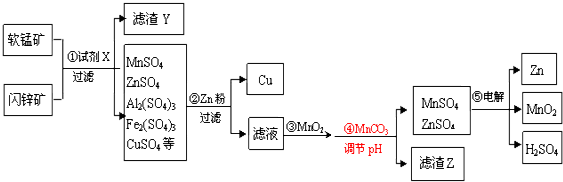
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素.已知:A为金属单质,C为黄绿色气体;D能将某种非金属氧化物氧化为F,F是含有三种元素的化合物.请回答下列问题:
A、B、C、D、E、F、G七种物质间存在如图所示转化关系,其中A、B、D、G含有同种元素.已知:A为金属单质,C为黄绿色气体;D能将某种非金属氧化物氧化为F,F是含有三种元素的化合物.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com