
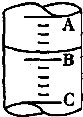
 ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ·ÖĪö £Ø1£©ÄĘČÜÓŚŃĪĖįŗó£¬ČÜŅŗŌö¼ÓµÄÖŹĮæ=ÄʵÄÖŹĮæ-ĒāĘųµÄÖŹĮæ£¬Ć¾ČÜÓŚŃĪĖįŗó£¬ČÜŅŗŌö¼ÓµÄÖŹĮæ=Ć¾µÄÖŹĮæ-ĒāĘųµÄÖŹĮ棻
£Ø2£©ĮæĶ²Š”æĢ¶ČŌŚĻĀ£¬¾«Č·¶ČĪŖ0.1mL£»
£Ø3£©ĮņĖįĒāÄĘĪŖĒæµē½āÖŹ£¬ĶźČ«µēĄė£»
NaHSO4ÓėBa£ØOH£©2°“ĪļÖŹµÄĮæ2£ŗ1»ģŗĻŌŚĖ®ČÜŅŗÖŠ·“Ӧɜ³ÉĮņĖį±µŗĶĖ®£®
½ā“š ½ā£ŗ£Ø1£©1molÄĘŗĶ1molĆ¾·“Ó¦Ź±ŃĪĖį¾ł¹żĮ棬ÄĘŗĶĆ¾¾łĶźČ«·“Ó¦£¬¹ŹÉś³ÉµÄĒāĘųµÄĪļÖŹµÄĮæČ”¾öÓŚÄĘŗĶĆ¾£®1molÄĘŗĶŃĪĖį·“Ӧɜ³É0.5molĒāĘų£¬1molĆ¾ŗĶ×ćĮæŃĪĖį·“Ӧɜ³É1molĒāĘų£¬ĀČ»ÆÄĘČÜŅŗÖŠŌö¼ÓµÄÖŹĮæ=23g/mol”Į1mol-0.5mol”Į2g/mol=22g£¬
ĀČ»ÆĆ¾ČÜŅŗÖŠŌö¼ÓµÄÖŹĮæ=24g/mol”Į1mol-1mol”Į2g/mol=22g£¬ĖłŅŌČÜŅŗaŗĶbµÄÖŹĮæ“󊔹ŲĻµĪŖma=mb£¬
¹Ź“š°øĪŖ£ŗ=£»
£Ø2£©ŅĄ¾ŻĮæĶ²¹¹ŌģæÉÖŖ£ŗBÓėCæĢ¶Č¼äĻą²ī1mL£¬Čē¹ūæĢ¶ČAĪŖ4£¬ŌņBĪŖ3mL£¬Ć抔øńĪŖ0.2mL£¬ÕżČ·µÄ¶ĮŹżĪŖ£ŗ3.2mL£»
¹Ź“š°øĪŖ£ŗ3.2£»
£Ø3£©¢ŁĮņĖįĒāÄĘĪŖĒæµē½āÖŹ£¬ĶźČ«µēĄė£¬µēĄė·½³ĢŹ½£ŗNaHSO4=Na++H++SO4 2-£»
¢ŚNaHSO4ÓėBa£ØOH£©2°“ĪļÖŹµÄĮæ2£ŗ1»ģŗĻŌŚĖ®ČÜŅŗÖŠ·“Ӧɜ³ÉĮņĖį±µŗĶĖ®£¬Ąė×Ó·½³ĢŹ½£ŗ2H++SO4 2-+Ba2++2OH-=BaSO4”ż+2H2O£»
¹Ź“š°øĪŖ£ŗ¢ŁNaHSO4=Na++H++SO4 2- ¢Ś2H++SO4 2-+Ba2++2OH-=BaSO4”ż+2H2O£®
µćĘĄ ±¾Ģāæ¼²éĮĖµē½āÖŹµēĄė·½³ĢŹ½µÄŹéŠ“”¢Ąė×Ó·½³ĢŹ½µÄŹéŠ“”¢ĮæĶ²µÄ¶ĮŹż£¬ÓŠ¹Ų·½³ĢŹ½µÄ¼ĘĖć£¬ĢāÄæÄŃ¶Č²»“ó£¬ÕĘĪÕ»ł“”ŹĒ½āĢā¹Ų¼ü£¬×¢Ņā¶Ō»ł“”ÖŖŹ¶µÄ»żĄŪ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ńõ»Æ¼ĮŗĶ»¹Ō¼Į¶¼ŹĒKMnO4 | |
| B£® | øĆ·“Ó¦µÄ»¹Ō²śĪļÖ»ÓŠMnO2 | |
| C£® | øĆ·“Ó¦µÄŃõ»Æ²śĪļŹĒO2 | |
| D£® | KMnO4ÖŠMnŌŖĖŲ±ķĻÖŃõ»ÆŠŌ£¬OŌŖĖŲ±ķĻÖ»¹ŌŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 2.0 | B£® | 12.3 | C£® | 1.7 | D£® | 12.0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1£ŗ1 | B£® | 2£ŗ1 | C£® | 4£ŗ3 | D£® | 2£ŗ3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| Ėį | µēĄė³£Źż |
| Ģ¼Ėį | K1=4”Į10-7 K2=5.6”Į10-11 |
| ŃĒĮņĖį | K1=1.54”Į10-2K2=1.02”Į10-7 |
| A£® | SO2+H2O+2CO32-ØT2 HCO3-+SO32- | B£® | SO2+H2O+CO32-ØTH2CO3+SO32- | ||
| C£® | 2SO2+2H2O+CO32-ØTH2CO3+2 HSO3- | D£® | SO2+H2O+CO32-ØTHCO3-+HSO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com