
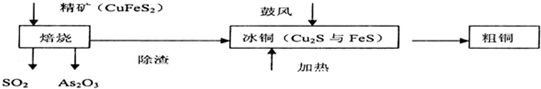
| ||
| 0.2mol |
| 2L |
| C(Cu 2 +) |
| C(Cu +) 2 |
| C(Cu 2 +) |
| C(Cu +) 2 |


科目:高中化学 来源: 题型:
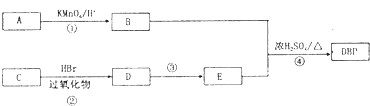 增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、洒类等行业.DBP是增塑剂的一种,分子式为C16H22O4,可由常见的工业原料A(分子式为C8H10)和C合成DBP的路线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
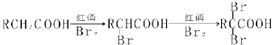
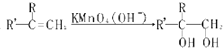

| 分析方法 | 相关信息 |
| 质谱法 | 相对分子质量为88 |
| 红外光谱 | 该化合物含有羧基 |
| 核磁共振氢谱 | 有三个峰,峰面积之比为1:1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 RCHO
RCHO
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 1 |
| 3 |
| A、-218kJ?mol-1 |
| B、-109kJ?mol-1 |
| C、+218kJ?mol-1 |
| D、+109kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com