
【题目】研究发现,3D-SiC@2D-MoS2异质接面催化剂具有优异的光催化CO2用纯水的全还原性能,有效实现电子/空穴的定向迁移,最终实现CO2和H2O在相应活性位点发生氧化还原反应,如图所示。下列叙述错误的是( )

A.2D-MoS2是H2O氧化的催化剂
B.H+和e-容易在SiC@MoS2催化剂间进行反应
C.中间产物的转化“HCOOH→HCHO→CH3OH”均发生还原反应
D.总反应的方程式为CO2(g)+2H2O(g)![]() CH4(g)+2O2(g)
CH4(g)+2O2(g)
【答案】B
【解析】
由图知①处水和二氧化碳在SiC@MoS2催化剂表面发生反应,水被氧化,变成氧气和氢离子,二氧化碳在①②③处生成中间产物 “HCOOH→HCHO→CH3OH”,均为被还原,并在 ④处反应后生成甲烷,所以图中反应物为二氧化碳和水,生成物为甲烷和氧气。
A.2D-MoS2是H2O被二氧化碳氧化的催化剂,故A正确;
B.H+和e-容易在SiC@MoS2催化剂表面进行反应,故B错误;
C.总反应的方程式为CO2(g)+2H2O(g)![]() CH4(g)+2O2(g),中间产物的转化包含“HCOOH→HCHO→CH3OH”的转化,酸被还原得到醛,醛被还原得到醇,故C正确;
CH4(g)+2O2(g),中间产物的转化包含“HCOOH→HCHO→CH3OH”的转化,酸被还原得到醛,醛被还原得到醇,故C正确;
D.上述分析得到总反应CO2(g)+2H2O(g)![]() CH4(g)+2O2(g),故D正确;
CH4(g)+2O2(g),故D正确;
故选:B。


科目:高中化学 来源: 题型:
【题目】向盛有Cl2的六个集气瓶甲、乙、丙、丁、戊、己中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙、丁、戊、己注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水 ④淀粉-KI溶液 ⑤FeCl2与KSCN混合液 ⑥NaBr溶液

A.④①②⑥⑤③ B.⑥①③④②⑤ C.⑥③②④①⑤ D.②①③④⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)《本草纲目》曾记载利尿剂甘汞(Hg2Cl2)制法:“用水银一两,白矾[KAl(SO4)212H2O]二两,食盐一两,同研,不见星。铺于器内,以小乌盆覆之,筛灶灰,盐水和,封固盘口,以炭打二柱香取开,则粉升于盆上矣,其白如雪,轻盈可爱,一两汞可升粉八钱。”
①KAl(SO4)212H2O所属物质类别为___________ (填标号)。
A.硫酸盐 B.酸式盐 C.正盐 D.电解质
②文中“则粉升于盆上矣”涉及的分离方法是___________。
③甘汞(Hg2Cl2)制备反应中,还原剂与氧化剂的物质的量之比为_______,该反应中还原产物是_______。
④由甘汞(Hg2Cl2)光照可得外科用药升汞(HgCl2),该反应化学方程式为_________。
(2)H2O2、酸性KMnO4在生产、生活、医疗卫生中常用作消毒剂,高锰酸钾造成的污渍可用草酸 (H2C2O4 )去除,完成下列问题。
①对于下列涉及H2O2的反应,H2O2仅体现氧化性的反应是_____(填标号,下同),H2O2既体现氧化性又体现还原性的反应是_______。
A.Ag2O+H2O2=2Ag+O2↑+H2O
B.2H2O2=2H2O+O2↑
C.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
②酸性高锰酸钾与草酸反应,氧化产物与还原产物的物质的量之比为___________。
③在稀硫酸中,KMnO4和H2O2反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类生活离不开化学,以下是补铁剂和胃药的两张标签的部分信息。
硫酸亚铁片 英文名:Ferrous Sulfate Tablets 本品含硫酸亚铁(FeSO4·7H2O)应为标示量的95.0%~110.0% | 氢氧化铝片 英文名:Aluminium Hydroxide Tablets |
(主要成分)糖衣、碳酸镁、氢氧化铝、淀粉 | |
(性状)本品为糖衣,除去糖衣后显淡绿色 | (适应症)能缓解胃酸过多 |
(鉴别)取本品,除去糖衣,称取适量(约相当于硫酸亚铁片0.2g),加稀盐酸1滴与水20mL,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应 | (用法用量)成人:口服,一次0.6~0.9g(一次2~3片),一日3次,餐前1小时服用 |
(详细用法)详见说明书 |
I、根据“硫酸亚铁片”标签回答问题:
(1)硫酸亚铁片溶于水后溶液的颜色是_______________。
(2)硫酸盐中检验![]() 的离子反应方程式是______________________________________。
的离子反应方程式是______________________________________。
(3)鉴别中,“加稀盐酸1滴”的作用是__________________________________________。
(4)检验硫酸亚铁片是否被氧化的方法是________________________________________。
II、根据“氢氧化铝片”标签回答问题:
(1)能缓解胃酸过多的成分是__________________________________________。
(2)氢氧化铝可作为治疗胃酸过多的内服药,这是利用了氢氧化铝的______________。
A. 酸性 B. 碱性 C. 两性 D. 氧化性
(3)写出氢氧化铝的电离方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物H是一种治疗心血管疾病药物的中间体。一种合成H的路线:
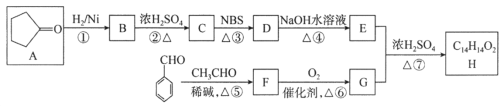
已知:信息① CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
信息② ![]()
回答下列问题:
(1)C的化学名称为________________,D中的官能团名称是__________________。
(2)②的反应类型是______________________________________。
(3)F的结构简式为______________________________________。
(4)写出由E和G生成H的化学方程式:__________________________________________。
(5)芳香族化合物Q是H的同分异构体,一定条件下,H和Q分别与足量H2加成,得到同一种产物,则Q的可能结构有________种(环中没有碳碳叁键,也没有连续的碳碳双键,不考虑立体结构),其中分子内存在碳碳叁键的同分异构体的结构简式为______________。
(6)呋喃丙烯酸(![]() )是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以
)是一种医治血吸虫病的药物 呋喃丙胺的原料。设计以![]() 为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
为原料合成呋喃丙烯酸的合成路线(无机试剂任选)。_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
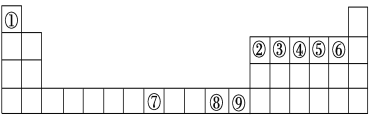
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的________区。
(2)④、⑥两元素形成的化合物的立体构型为________,其中心原子的杂化轨道类型为________。
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为___________。
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是____,写出与化合物A互为等电子体的一种阳离子______(填离子符号)。
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是______(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型),化合物中⑦的化合价为:_______。根据等电子体理论,该化合物的配体的结构式为:_______,CaC2中,阴离子的电子式为: ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛是制备乙酸、乙酸衍生物等化工产品的原料。完成下列填空:
(1)乙醛分子中的官能团为______。
(2)将铜丝在空气中灼烧变黑后,迅速伸入乙醇中,观察到铜丝表面______;反复上述多次操作后,闻到刺激性气味,说明有______生成。
(3)写出检验乙醛的化学反应方程式。______上述反应显示乙醛具有______性。
(4)已知甲酸也能发生银镜反应,若某甲酸溶液中可能混有乙醛,如何通过实验证明是否含有乙醛并写出简要操作步骤________________
(5)已知:有机化学中将紧邻官能团的第一个碳原子成为α—C,α—C上的H就称为α—H,醛的α—H较活泼,可以和另一个醛的羰基进行加成,生成羟基醛,如:
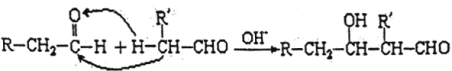
设计一条以乙烯为原料制备正丁醇CH3CH2CH2CH2OH的合成路线(无机试剂任选):_________(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电解原理将SO2、NOx转化为(NH4)2SO4的装置如图所示。下列说法错误的是( )
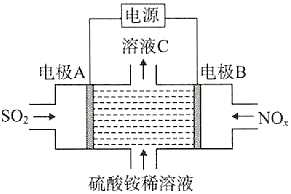
A.阴极的电极反应式:NOx+(2x+3)e-+(2x+4)H+=NH4++xH2O
B.溶液C的酸性比硫酸铵稀溶液强
C.电极A与电源的负极相连,发生氧化反应
D.转移0.2mol电子时消耗0.1molSO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com