
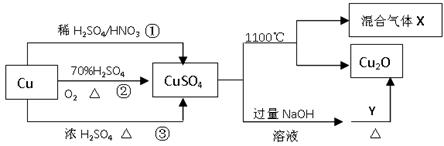
| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2 |
| B.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| C.1molCuSO4在1100℃所得混合气体X中O2一定为0.75mol |
| D.Y可以是葡萄糖 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.饱和Na2CO3溶液;无水CaCl2固体 | B.饱和NaHCO3溶液;浓H2SO4 |
| C.浓H2SO4;饱和Na2CO3溶液 | D.饱和Na2CO3溶液;稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.可以按此建议改进,便于使用容量瓶 |
| B.不能按此建议改进,因为会降低容量瓶的精确度 |
| C.如果加粗瓶颈,可将原来刻在容量瓶瓶颈上的刻度线改刻在容量瓶的瓶身上 |
| D.不必加粗瓶颈,因为向容量瓶中转移液体时,有少量液体倒出瓶外,不会对溶液的浓度产生太大影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.容量瓶使用前有蒸馏水 |
| B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
| C.俯视确定凹液面与刻度线相切 |
| D.称量NaOH固体时使用了称量纸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5~9 | B.4.0~10.0 | C.4.3~9.7 | D.以上都不正确 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制一定体积的物质的量浓度溶液,定容时仰视,会使浓度偏低 |
| B.盛装水玻璃和氢氧化钠溶液的试剂瓶,都不能使用磨口玻璃塞 |
| C.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性 |
| D.常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
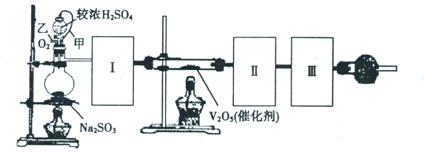
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com