
| A、Na→Na2O2→NaOH→Na2CO3?10H2O→Na2CO3 |
| B、Na→Na2O→NaOH→Na2CO3?10H2O→Na2CO3 |
| C、Na→Na2O2→NaOH→Na2CO3?10H2O→HaHCO3 |
| D、Na→Na2O→NaOH→Na2CO3?10H2O→NaHCO3 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| B、12g石墨含有的共价键数为0.5NA |
| C、在碳酸钠溶液中,若CO32-离子数为NA,则Na+离子数就为2NA |
| D、常温、常压下,14g CO与N2的混合气含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应温度(℃) | 反应物 | H2O | ||||
| Na2S2O3 | H2SO4 | V(mL) | ||||
| V(mL) | c(mol/L) | V(mL) | c(mol/L) | |||
| A | 10 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 10 | 5 | 0.1 | 5 | 0.1 | 10 |
| C | 30 | 5 | 0.1 | 5 | 0.1 | 10 |
| D | 30 | 5 | 0.2 | 5 | 0.2 | 10 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用催化剂是为了加快反应速率 |
| B、在上述条件下,H2不可能100%地转化为NH3 |
| C、平衡时速率V (N2):V (NH3)=1:2 |
| D、达到平衡时,N2的浓度与NH3浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠溶液应保存在带磨砂玻璃塞的无色细口瓶中 |
| B、硅是制造光导纤维的材料 |
| C、水玻璃可用作木材防火剂 |
| D、水晶是一种无色,坚硬难熔的硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、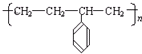 的单体为CH2=CH2和 的单体为CH2=CH2和 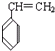 |
| B、分子式符合Cn(H2O)m的物质,都是糖类物质 |
| C、淀粉、纤维素都是天然有机高分子化合物 |
| D、淀粉和纤维素都是由碳氢氧三种元素组成,两化合物中三元素的质量比相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
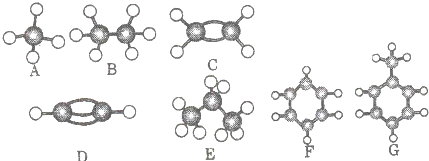
查看答案和解析>>
科目:高中化学 来源: 题型:
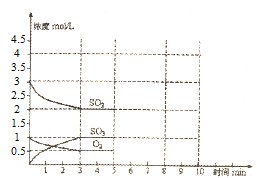 已知硫酸工业生产过程中涉及的化学反应有:
已知硫酸工业生产过程中涉及的化学反应有:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com