
| A. | 新制氯水中只含Cl2和H2O 分子 | |
| B. | 新制氯水可使蓝色石蕊试纸变红且不褪色 | |
| C. | 光照氯水有气泡逸出,该气体是Cl2 | |
| D. | 氯水放置数天后酸性将变强 |
分析 氯水中,氯气与水发生反应:Cl2+H2O?HClO+HCl,溶液中含有Cl2、HClO、H2O等分子,含有H+、ClO-、Cl-等离子,氯水具有酸性和强氧化性,其中HClO见光易分解而变质,据此对各选项判断.
解答 解:A、新制氯水中含有的分子有:Cl2、HClO、H2O,故A错误;
B、新制氯水中含有H+,可使蓝色石蕊试纸变红,含有HClO,具有强氧化性,可使试纸褪色,故B错误;
C、氯水中含有HClO,不稳定,见光易分解生成氧气,该气体是O2,故C错误;
D、氯水放置数天后,次氯酸分解生成盐酸,溶液的酸性增强,故D正确;
故选D.
点评 本题综合考查氯气和氯水的性质,题目难度中等,注意把握氯气和水反应的特点以及氯水的成分和性质,为高考高频考点,侧重于基础知识的综合运用,有利于培养学生灵活应用所学知识的能力.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L | B. | 0.2mol/L | C. | 0.4mol/L | D. | 0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体 | |
| B. | 用KOH溶液鉴别NH4Cl、AlCl3、MgSO4、FeCl3四种溶液 | |
| C. | 用盐酸溶液鉴别Na2CO3溶液和Na2SiO3溶液 | |
| D. | 用BaCl2溶液鉴别AgNO3和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -CHO的电子式: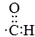 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 乙烯的结构简式为:CH2CH2 | D. | 丙烷分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=12的溶液:NH4+、Na+、Cl-、HCO3- | |
| B. | 能使pH试纸变红色的溶液:Na+、Al3+、NO3-、SO42- | |
| C. | 含有大量Fe3+的溶液:SCN-、I-、K+、Br- | |
| D. | 澄清透明的无色溶液:ClO-、MnO4-、Al3+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 2:15 | C. | 2:11 | D. | 1:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
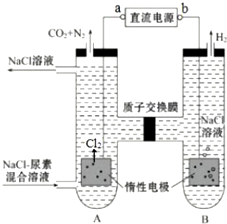 氨在国民经济中占有重要地位,具有广泛的用途.
氨在国民经济中占有重要地位,具有广泛的用途. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com