
【题目】下列电离方程式错误的是( )
A.NaHCO3═Na++H++CO ![]()
B.NaHSO4(溶液)═Na++H++SO ![]()
C.MgCl2═Mg2++2Cl﹣
D.Ba(OH)2═Ba2++2OH﹣
科目:高中化学 来源: 题型:
【题目】以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH﹣ ④NH4+ ⑤Fe(CO)5⑥Fe(SCN)3⑦H3O+
⑧[Ag(NH3)2]OH ⑨[B(OH)4]﹣ .
A.①②④⑦⑧
B.③④⑤⑥⑦⑨
C.①④⑤⑥⑦⑧⑨
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干电池原理如图所示,电池总反应为Zn+2NH4+═Zn2++2NH3↑+H2↑.下列说法正确的是( ) 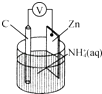
A.碳电极上发生还原反应
B.Zn极上发生还原反应
C.常见锌锰干电池为二次电池
D.负极上发生的反应为2NH4++2e﹣═2NH3↑+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一个土豆(含有过氧化氢酶)切成大小和厚薄相同的若干片,放入盛有一定体积和浓度的过氧化氢溶液的针筒中(如右图所示)。若土豆片为4片时,在温度为15℃的条件下,每隔5分钟收集一次数据,并绘制出如图曲线1。利用同样的实验装置,改变某一种条件后,收集数据可绘制出曲线2。则改变的条件是

A. 降低过氧化氢溶液的浓度 B. 增加土豆片的数量
C. 将温度提高到25℃ D. 将针筒换成容积更大的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在指定的环境中一定能大量共存的是( )
A.常温下,在c(H+)/c(OH﹣)=1×1012的溶液中:I﹣、Cl﹣、NO ![]() 、Na+
、Na+
B.在能使石蕊变红色的溶液中:Na+、S2﹣、SO ![]() 、CO
、CO ![]()
C.在加入铝粉能产生H2的溶液中:NH ![]() 、Na+、NO
、Na+、NO ![]() 、Cl﹣
、Cl﹣
D.常温下由水电离出的c(H+)=1×10﹣12 mol?L﹣1的溶液中:K+、Cl﹣、NO ![]() 、Na+
、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数K= ![]() .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把V L含有MgSO4和Al2(SO4)3的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使铝离子完全转化为AlO2﹣(1mol铝离子消耗4molNaOH生成1mol AlO2﹣);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为BaSO4 . 则原混合溶液中Mg2+的浓度为( )
A.![]() mol?L﹣1
mol?L﹣1
B.![]() mol?L﹣1
mol?L﹣1
C.![]() mol?L﹣1
mol?L﹣1
D.![]() mol?L﹣1
mol?L﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com