
【题目】物质检验、分离、提纯和制备是化学实验中的常见操作。
(1)除去FeCl3溶液中混有的FeCl2可采取的方法是______(用离子方程式表示)。
(2)检验食盐中所含阳离子的实验操作名称是_________。
(3)检验Fe2(SO4)3溶液中是否含有FeSO4所用试剂是_________。
(4)实验室制备氯气的化学反应方程式为_______,请在方程式中标出电子转移的方向和数目。
【答案】2Fe2++Cl2 = 2Fe3++2Cl-或2Fe2++H2O2+2H+ = 2Fe3++2H2O 焰色实验(或焰色反应) 酸性高锰酸钾溶液(或铁氰化钾溶液) 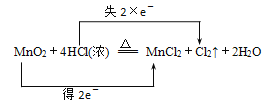
【解析】
(1)可以向混合液中通入氯气(或滴加双氧水)除去FeCl3溶液中混有的FeCl2,离子方程式:2Fe2++Cl2═2Fe3++2Cl﹣或2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)检验食盐中所含阳离子的实验操作名称是焰色实验(或焰色反应),;
(3)亚铁离子具有还原性(或遇到铁氰化钾溶液产生蓝色沉淀),因此检验Fe2(SO4)3溶液中是否含有FeSO4所用试剂是酸性高锰酸钾溶液(或铁氰化钾溶液);
(4)浓盐酸与二氧化锰加热可制备氯气,Mn元素的化合价降低、Cl元素的化合价升高,则反应及转移电子方向和数目为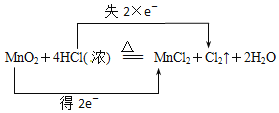 。
。


科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )
、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如图,下列说法正确的是( )

A.气体A是NO2
B.X溶液中肯定存在Fe2+、Al3+、![]() 、
、![]()
C.溶液E和气体F不能发生化学反应
D.X溶液中不能确定的离子是Al3+和Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
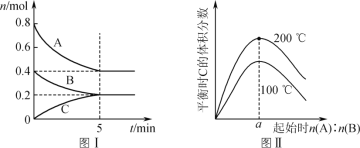
A.200 ℃时,反应达平衡时的平均速率v(B)=0.002 mol·(L·min)-1
B.图Ⅱ所知反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
C.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿“烧渣”(主要成分:Fe3O4、Fe2O3和FeO)制备绿矾(FeSO4·7H2O))的流程如图:
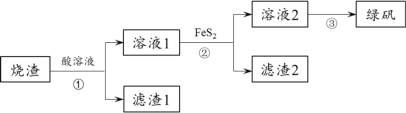
已知:①FeS2(S的化合价为-1)难溶于水。②FeS2+7Fe2(SO4)3+8H2O =15FeSO4+8H2SO4
(1)①中加入的酸为________,滤渣2的主要成分是 __________。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、___________。
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,________。
(4)通过③得到绿矾晶体的实验操作:____________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧、硫、硒(Se)、碲(Te)、钋(Po)是元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1)硒在元素周期表中的位置________。
(2)![]() Po的中子数为________。
Po的中子数为________。
(3)某温度时,该族单质与H2反应生成气态H2X的热化学方程式如下:
O2(g)+2H2(g)=2H2O(g) △H1=-484 kJ/mol
S(g)+H2(g)![]() H2S(g) △H2=-20 kJ/mol
H2S(g) △H2=-20 kJ/mol
Se(g)+H2(g)![]() H2Se(g) △H3=+81kJ/mol
H2Se(g) △H3=+81kJ/mol
①硫和硒氢化物的热稳定性:H2S________ H2Se(填“>”、“=”或“<”);判断依据是________。
②写出O2(g)与H2S(g)反应生成H2O(g)和S(g)的热化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓解当前能源和资源紧张问题的方法无非是开源和节流两个方面,从开源角度看,有效地开发利用燃煤产生的CO2重新合成新的燃料是一个途径,目前工业上用CO2来生产甲醇的原理是CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
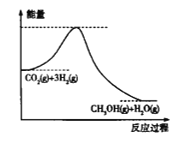
(1)上述反应过程中的能量变化如图所示,该反应是_____________(填“吸热”或“放热”)反应。
(2)一定温度下,将5molCO2和8molH2充入2L恒容密闭容器中发生上述反应,测得H2的物质的量与时间的关系如图所示,

0-1min内,用CO2表示的平均反应速率v(CO2)=________________(保留两位有效数字);a点的逆反应速率________________b点的逆反应速率(填“>”“<”或“=”)。
(3)对于在恒温恒容条件下进行的反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下列叙述不能说明其已达到平衡状态的是________________(填序号)。
CH3OH(g)+H2O(g),下列叙述不能说明其已达到平衡状态的是________________(填序号)。
a. 混合气体的密度不再改变
b. 容器内的压强不再发生变化
c. CH3OH(g)的浓度保持不变
d. 单位时间内消耗1molCO2,同时生成1molCH3OH
(4)甲醇燃料电池是一种高效、环境友好的发电装置,结构如图所示(电解质溶液为稀硫酸):
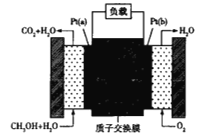
①Pt(b)电极上发生_____________(填“氧化”或“还原”)反应,电极反应式为________________________。
②如果该电池工作时导线中通过3mol电子,则理论上消耗甲醇的物质的量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸胺(H2NCOONH4)固体,置于特制密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使反应: H2NCOONH4(s)![]() 2NH3(g)+CO2(g)达到分解平衡,实验测得不同温度及反应时间(t1<t2<t3)的有关表格:
2NH3(g)+CO2(g)达到分解平衡,实验测得不同温度及反应时间(t1<t2<t3)的有关表格:
氨基甲酸铵分解时温度、气体总浓度及反应时间的关系。
温度/℃ 气体总浓度(mol/L) 时间/min | 15 | 25 | 35 |
0 | 0 | 0 | 0 |
t1 | 0.9×10-3 | 2.7×10-3 | 8.1×10-3 |
t2 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
t3 | 2.4×10-3 | 4.8×10-3 | 9.4×10-3 |
(1)在25℃,0-t1时间内产生氨气的平均速率为___。
(2)根据表中数据换算出,15℃时合成反应2NH3(g)+CO2(g)![]() H2NCOONH4(s)平衡常数K约为___。
H2NCOONH4(s)平衡常数K约为___。
(3)以捕捉到的CO2与H2为原料可合成甲醇(CH3OH),其反应的化学方程为:CO2(g)+3H2(g)![]() CH3OH(g)+H2(g) ΔH<0在恒温恒容的密闭容器中,加入1molCO2和3molH2,充分反应达平衡时放出热量akJ,若在原容器中加入2molCO2和6molH2,在相同温度下反应达平衡时放热bkJ,则a和b满足的关系___。
CH3OH(g)+H2(g) ΔH<0在恒温恒容的密闭容器中,加入1molCO2和3molH2,充分反应达平衡时放出热量akJ,若在原容器中加入2molCO2和6molH2,在相同温度下反应达平衡时放热bkJ,则a和b满足的关系___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com