
分析 (1)热化学方程式要标明物质的聚集状态,并且焓变的符号和单位要正确,根据热化学方程式的书写方法来回答;
(2)结合化学反应④⑤,利用盖斯定律来回答;
(3)物质燃烧伴随热量的释放的化学反应是物质燃烧热的热化学方程式;
(4)酸碱中和生成盐和水并伴随热量的释放的反应是中和热的热化学方程式.
解答 解:(1)根据热化学方程式的书写方法,①②③都是有错误的,错误之处分别是:①中CaO没标状态,△H=+177.7/mol,②的状态应为“g”,△H=+131.KJ/mol,③除H2O外其它物质的状态不是“l”应为“aq”;
故答案为:①②③;
(2)结合化学反应④⑤,利用盖斯定律,反应C(s)+$\frac{1}{2}$O2(g)=CO(g)是④-⑤得来,所以焓变△H=-110.5KJ/mol,故答案为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol;
故答案为:C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol;
(3)物质燃烧伴随热量的释放的化学反应是物质燃烧热的热化学方程式,故上述反应中④⑤分别是表示C、CO燃烧热的热化学方程式,
故答案为:④⑤;
(4)酸碱中和生成盐和水并伴随热量的释放的反应是中和热的热化学方程式,故⑥表示的是中和热的热化学方程式,
故答案为:⑥.
点评 本题考查学生热化学方程式的书写方法以及盖斯定律计算化学反应的焓变等知识,注意知识的归纳和整理是解题关键,难度不大.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
| t/s | 0 | 30 | 150 | 250 | 350 | 450 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②乙烯③CH3COOH④CH3CH2OH⑤CH2═CH-COOH ⑥
②乙烯③CH3COOH④CH3CH2OH⑤CH2═CH-COOH ⑥
| A. | ①⑤ | B. | ①②④⑥ | C. | ①④ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
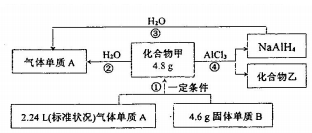
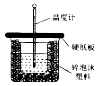 (1)在一定条件下N2与H2反应生成NH3,请回答:
(1)在一定条件下N2与H2反应生成NH3,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓氨水中加固体NaOH | B. | 混合NH4Cl溶液和NaOH溶液 | ||
| C. | 加热分解NH4Cl晶体 | D. | 加热消石灰和NH4NO3的固体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com