
| A.残余固体全部是铜 | B.残余固体可能为铁和铜的混合物 |
| C.残余固体是铁,溶液中一定不含Cu2+ | D.最后得到的溶液可能含有Fe3+ |
科目:高中化学 来源:不详 题型:单选题

A.在空气中加热 | B.加入足量的水,充分搅拌后过滤 | C.加入足量的NaOH溶液,充分反应后过滤 | D.加入足量的盐酸,充分反应后过滤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.4.18g | B.3.12g | C.4.68g | D.5.08 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 |  | Zn+Fe2+=Zn2++Fe | |
| ③ | 在FeCl3溶液中加入足量铁粉 | | Fe+2Fe3+=3 Fe2+ | Fe3+具有氧化性 |
| ④ | |  | | Fe3+具有氧化性 |
| A.Cl2 | B.Na | C.Na+ | D.Cl- E.SO2 F.NO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的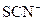 被过量的氯水氧化 被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
| | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.该晶体中一定含有SCN— | B.氧化性:Fe3+> Cl2 |
| C.Fe2+与SCN—不能形成红色物质 | D.Fe2+被氯水氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ______________________。
______________________。 料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。
料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的 金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 |
| B | 常温下铁与稀硫酸反应 生成氢气 | 高温下氢气能还原氧化 铁得到铁 | Ⅰ对;Ⅱ对;无 |
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 |
| D | 在空气中铁的表面能形 成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
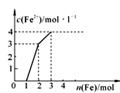
| A.2∶1∶4 | B.1∶2∶4 | C.1∶2∶1 | D.1∶1∶4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com