
【题目】近年来,由于石油价格的不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以煤为原料生产聚乙烯(PVC)和人造羊毛的合成线路。
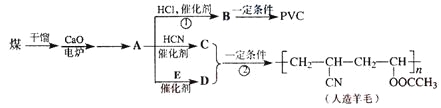
请回答下列问题:
(1)写出反应类型:反应①______________,反应②__________________。
(2)写出结构简式:PVC________________,C______________________。
(3)写出A![]() D的化学方程式_______________________________。
D的化学方程式_______________________________。
(4)与D互为同分异构体且可发生碱性水解的物质有________种(不包括环状化合物),写出其中一种的结构简式_______________________________________。
【答案】加成反应 加聚反应 ![]() H2C=HC-CN HC≡CH+CH3COOH
H2C=HC-CN HC≡CH+CH3COOH![]() H2C=CH-OOCCH3 4 CH2=CHCOOCH3
H2C=CH-OOCCH3 4 CH2=CHCOOCH3
【解析】
煤干馏得到焦炭,焦炭在电炉中和氧化钙发生反应,生成碳化钙,CaC2与水反应生成氢氧化钙与乙炔,由转化关系可知A为CH≡CH,CH≡CH与HCl发生加成反应生成CH2═CHCl,CH2═CHCl发生加聚反应生成聚氯乙烯![]() ,故B为CH2═CHCl,PVC为
,故B为CH2═CHCl,PVC为![]() ,CH≡CH与HCN发生加成反应生成CH2═CHCN,CH2═CHCN与D通过加聚反应合成人造羊毛,故D为CH2=CHOOCCH3,乙炔与E反应生成CH2=COOCCH3,故E为CH3COOH,据此解答。
,CH≡CH与HCN发生加成反应生成CH2═CHCN,CH2═CHCN与D通过加聚反应合成人造羊毛,故D为CH2=CHOOCCH3,乙炔与E反应生成CH2=COOCCH3,故E为CH3COOH,据此解答。
(1)根据上面的分析可知,反应①是加成反应,人造羊毛( )是由单体H2C═CH-OOCCH3和H2C═CH-CN,通过加聚反应而形成,所以反应②为加聚反应,
)是由单体H2C═CH-OOCCH3和H2C═CH-CN,通过加聚反应而形成,所以反应②为加聚反应,
故答案为加成反应;加聚反应;
(2)根据上面的分析可知,PVC为![]() ,C为H2C═CH-CN,
,C为H2C═CH-CN,
故答案为![]() ;H2C═CH-CN;
;H2C═CH-CN;
(3)D为CH2═CHOOCCH3,它是由乙炔和E发生加成反应生成的,而E为乙酸,所以反应的方程式为HC≡CH+CH3COOH![]() H2C=CH-OOCCH3,
H2C=CH-OOCCH3,
故答案为HC≡CH+CH3COOH![]() H2C=CH-OOCCH3;
H2C=CH-OOCCH3;
(4)与CH2=CHOOCCH3互为同分异构体且可发生碱性水解的物质,该物质含有酯基(不包括环状化合物),可能结构有:CH2=CHCOOCH3、CH2=CHCH2OOCH、CH3CH=CHOOCH、CH2=C(CH3)OOCH,
故答案为4,CH2=CHCOOCH3或CH2=CHCH2OOCH或CH3CH=CHOOCH或CH2=C(CH3)OOCH。


科目:高中化学 来源: 题型:
【题目】北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物。将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等。在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回。下列分析中正确的是( )

A. 题干中所举出的6种钾石墨,属于同素异形体
B. 若某钾石墨的原于分布如图一所示,则它所表示的是C24K
C. 若某钾石墨的原子分布如图二所示,则它所表示的是C12K
D. 另有一种灰色的钾石墨C32K,其中K的分布也类似图中的中心六边形,则最近两个K原子之间的距离为石墨键长的4![]() 倍
倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】β-氮化碳的硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示。下列说法不正确的是( )
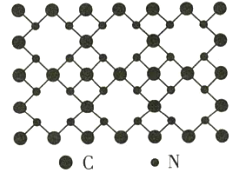
A.该晶体中的碳、氮原子都满足8电子稳定结构
B.该晶体中碳显+4价,氮显-3价
C.该晶体中每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
D.该晶体的分子式为C3N4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物的应用广泛。试回答下列问题:
(1)基态![]() 原子的价电子轨道表示式为__________,其第一电离能比
原子的价电子轨道表示式为__________,其第一电离能比![]() 的__________(填“大”或“小”)。
的__________(填“大”或“小”)。
(2)氨硼烷(![]() )被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的原子是__________,写出一种与氨硼烷互为等电子体的有机小分子:___________________(填化学式)。
)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的原子是__________,写出一种与氨硼烷互为等电子体的有机小分子:___________________(填化学式)。
(3)常温常压下硼酸(![]() )的晶体结构为层状,其二维平面结构如图所示。
)的晶体结构为层状,其二维平面结构如图所示。
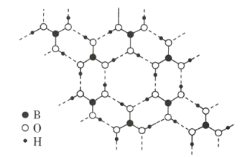
①B原子的杂化方式为__________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大: _________________。
②路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:
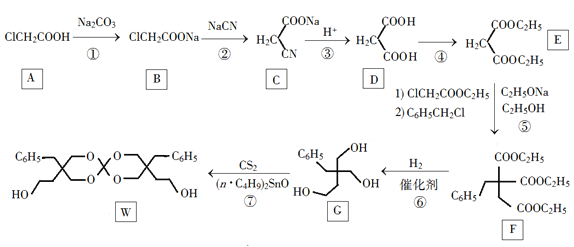
回答下列问题:
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。
(7)苯乙酸苄酯(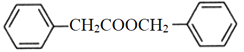 )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯分子中不存在碳碳单键和碳碳双键的交替结构,下列可以证明该结论的事实是( )
①苯不能使酸性![]() 溶液褪色 ②苯分子中碳碳键的键长完全相等 ③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷 ④经实验测得对二甲苯只有一种结构 ⑤苯在溴化铁作催化剂条件下与液溴可发生取代反应,但不能因发生化学反应而使溴水褪色
溶液褪色 ②苯分子中碳碳键的键长完全相等 ③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷 ④经实验测得对二甲苯只有一种结构 ⑤苯在溴化铁作催化剂条件下与液溴可发生取代反应,但不能因发生化学反应而使溴水褪色
A.②③④B.②④⑥C.①②⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学研究小组制备硝基苯的实验装置如图所示,相关数据见下表。已知该实验中存在的主要副反应是:在温度稍高的情况下会生成间二硝基苯。
物质 | 熔点/℃ | 沸点/℃ | 密度/( | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
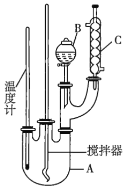
实验步骤如下:
取![]() 浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心加入
浓硫酸与足量浓硝酸配制成混合酸,将混合酸小心加入![]() 中。取
中。取![]() 苯加入
苯加入![]() 中。在室温下,向苯中逐滴加入混合酸,边滴加边搅拌,混合均匀加热,使其在/span>50~60℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、
中。在室温下,向苯中逐滴加入混合酸,边滴加边搅拌,混合均匀加热,使其在/span>50~60℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、![]() 溶液和水洗涤。在分出的产物中加入无水
溶液和水洗涤。在分出的产物中加入无水![]() 颗粒,静置片刻,过滤,对滤液进行蒸馏纯化,收集205~210℃的馏分,得到纯硝基苯
颗粒,静置片刻,过滤,对滤液进行蒸馏纯化,收集205~210℃的馏分,得到纯硝基苯![]() 。
。
回答下列问题:
(1)图中装置![]() 的作用是______。
的作用是______。
(2)制备硝基苯的化学反应方程式为___________。
(3)配制混合酸时,能否将浓硝酸加入到浓硫酸中?_____(填“能”或“不能”),说明理由:_______。
(4)为了使反应在50-60 ℃下进行,常采用的加热方法是_____。反应结束并冷却至室温后![]() 中液体为粗硝基苯,粗硝基苯呈黄色的原因是_________。
中液体为粗硝基苯,粗硝基苯呈黄色的原因是_________。
(5)在洗涤操作中,第二次水洗的目的是____。
(6)本实验所得到的硝基苯的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(GaN)是第三代半导体材料,具有热导率高、化学稳定性好等性质,在光电领域和高频微波器件应用等方面有广阔的前景。
(1)传统的氮化镓制各方法是采用GaC13与NH3在一定条件下反应。NH3的电子式为___。
(2)Johnson等人首次在1100℃下用液态镓与氨气制得氮化镓固体,该可逆反应每生成1 mol H2放出10.3 kJ热量。其热化学方程式为_________。
(3)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中NH3的体积分数与压强(p)、温度(T)的关系如图所示。
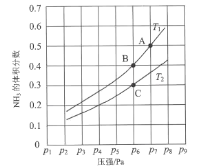
①下列说法正确的是___(填标号)。
a. 温度:T1>T2
b. 当百分含量ω(NH3)=ω(H2)时,说明该反应处于化学平衡状态
c. A点的反应速率小于C点的反应速率
d. 温度恒定为T2,达平衡后再充入氦气(氦气不参与反应),NH3的转化率不变
②既能提高反应速率又能使平衡正向移动的措施有___(写出一条即可)。
③气体分压(p分)=气体总压(p总)×体积分数,用平衡分压代替物质的量浓度也可以表示平衡常数(记作Kp)。在T2时,用含p6的计算式表示C点的______。
(4)如图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向______(填“左”或“右”)池移动;铜电极上发生反应的电极反应式为_______。
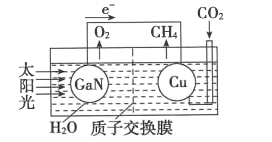
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为“21世纪的金属”,可呈现多种化合价。其中以+4价的Ti最为稳定。回答下列问题:
(1)基态Ti原子的价电子排布图为__。
(2)已知电离能:I2(Ti)=1310kJ·mol-1,I2(K)=3051kJ·mol-1。I2(Ti)<I2(K),其原因为__。
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:
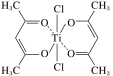
①钛的配位数为__,碳原子的杂化类型__。
②该配合物中存在的化学键有__(填字母)。
a.离子健 b.配位键 c.金属健 d.共价键 e.氢键
(4)钛与卤素形成的化合物熔、沸点如下表所示:
TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | -24.1 | 38.3 | 155 |
沸点/℃ | 136.5 | 233.5 | 377 |
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是__。
(5)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为_。阴离子的立体构型为__。
![]()
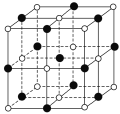
(6)已知TiN晶体的晶胞结构如图所示,若该晶胞的密度为ρg·cm-3,阿伏加德罗常数值为NA,则晶胞中Ti原子与N原子的最近距离为___pm。(用含ρ、NA的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com