
| �������� |
| ������� |
| 9.25 |
| 22.4��0.5 |
| 0.200 |
| 2 |
| ������������� |
| ����������� |
16��0.800+28��
| ||||
| 0.900��22.4 |
| ||
| 0.900 |


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ɱ� | B���Ȼ������� |
| C�����ʯ | D���Ȼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����̼����þ��Һ�м�������Ca��OH��2��Һ��Mg2++2HCO3-+Ca2++2OH-=MgCO3��+CaCO3��+2H2O |
| B����0.5molCl2ͨ�뺬2molFeBr2����Һ�У�Cl2+2Fe2+=2Fe3++2Cl- |
| C��̼�ᱵ����ϡ�����У�BaCO3+2H+=Ba2++CO2��+H2O |
| D��Fe��OH��3��������Fe��OH��3+3H+=Fe3++3H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1molFe��0.1molCl2��ַ�Ӧת�Ƶ�����Ϊ0.2NA |
| B��16g�������ӣ�13CH3+������������Ϊ9NA |
| C�����ڷ�Ӧ��C2H2��g��+2.5O2��g����2CO2��g��+H2O��1��+1300kJ����CO2����4NA�Թ��õ��Ӷ����ɣ���ų�����Ϊ1300kJ |
| D��0��lmol/LFe2��SO4��3��Һ200mL�������Ӻ�����������Ϊ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ʵ�����ô���ʯ��ϡ������ȡCO2��2H++CO32-=CO2��+H2O |
| B������������Һ�����ᷴӦ��OH-+H+=H2O |
| C����ϡ������Һ�м���Ƭ��3Fe+6H+=3Fe3++3H2�� |
| D����Ͷ��ˮ�У�Na+H2O=Na++OH-+H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
(10��) ����A��B��C�����ձ��зֱ�ʢ����ͬŨ�ȵ�ϡ���ᣬ��ͼ��ʾ��

��A�з�Ӧ�����ӷ���ʽΪ��_______________________________��
��B��Sn��������Һ��pH________(���������С�����䡱)��
�۱Ƚ�A��B��C��������ʴ�����ʣ��ɿ쵽����˳����________________��
����ͼ��ʾ���ס������ص缫���϶���������̼������ش��������⣺
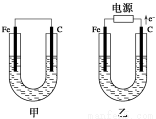
��1���������е������Һ��ΪCuSO4��Һ����Ӧһ��ʱ���
���к�ɫ�����������Ǽ׳��е�________����
���ҳ��������ĵ缫��Ӧʽ��___________________��
��2���������е������Һ��Ϊ����NaCl��Һ��
�ټ׳���̼���ϵ缫��Ӧʽ��_____________________��
���ҳص��һ��ʱ���֪��Һ���Ϊ200ml��PH=13,���������ɵ������ڱ�״���������______L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����Һ(NH4)2SO4�У�����Ũ�ȴ�С˳����ȷ����
A��c(NH4+)> c(SO42��)>c(H��)>c(OH��)
B��c(SO42��)>c(NH4+)>c(OH��)>c(H��)
C��c(NH4+)>c(SO42��)>c(OH��)>c(H��)
D��c(SO42��)>c(H��)>c(NH4+)>c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
CaCO3����������Һ���У��ܽ�����
A��HCl B��Na2CO3��Һ C��CaCl2��Һ D���Ҵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���ѧ�����л�ѧ�������Ծ��������棩 ���ͣ������
(16��)������ĿҪ������
��1���������߱�ʾ±��Ԫ��ij��������˵���������ı仯���ƣ���ȷ���� ��

��2���������ʱ仯��ֻ�뷶�»����йص��� ��
A���ɱ��ۻ�
B����������
C���Ҵ���ˮ����
D�����������Ȼ�̼
E��ʯӢ����
��3����֪0.1 mol CrCl3��6H2O��ˮ��Һ���ù�����������Һ����������0.2 mol AgCl����������������п��ܵĻ�ѧʽ�� ��
A��[Cr(H2O)6]Cl3 B��[Cr(H2O)5Cl]Cl2��H2O
C��[Cr(H2O)4Cl2]Cl��2H2O D��[Cr(H2O)3Cl3]��3H2O
��4���������ڵ�ء��Ͻ𡢴����ȷ���Ӧ�ù㷺��Ni��Ԫ�����ڱ��е�28��Ԫ�ء�
�ٵ�2���ڻ�̬ԭ��δ�ɶԵ�������Ni��ͬ�ҵ縺����С��Ԫ���� ��
��NiO��FeO�ľ���ṹ���;����Ȼ��Ƶ���ͬ��Ni2+��Fe2+�����Ӱ뾶�ֱ�Ϊ69 pm��78 pm�����۵�NiO ________ FeO(�<����>��)��
��CO��N2�ṹ����,CO�����ڦҼ���м�����֮��Ϊ ��Ni��Fe��Co�Ƚ���������CO��Ӧ�γ������ ��Fe(CO)5�����³�Һ̬���۵�Ϊ��20.5�棬�е�Ϊ103�棬�����ڷǼ����ܼ����ݴ˿��ж�Fe(CO)5������
�� ��������� ����
����³ʿ����һ������������Ⱦ�ϣ����ľ����ṹ��ͼ��ʾ������K+������λ�ã�δ���������³ʿ���� n(Fe3+)��n(CNһ)= _____ ��

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com