
下列有关离子方程式与所述事实相符的是
A.用过氧化氢从酸化的海带灰浸出液中提取碘:
B.某溶液中存在大量 ,加入NaOH溶液发生反应:
,加入NaOH溶液发生反应: =Fe(OH)3↓
=Fe(OH)3↓
C.向AlCl3溶液中投入过量的Na: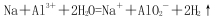
D.将Na2O2固体投入H218O中:
科目:高中化学 来源:2015-2016学年福建省高二上学期半期考试化学试卷(解析版) 题型:选择题
实验室配制1mol/L 250mL NaCl溶液,下列仪器中不需要的是
A.玻璃棒 B.分液漏斗 C.胶头滴管 D.250mL容量瓶
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二上学期期中测试化学试卷(解析版) 题型:选择题
在下列过程中,需要加快化学反应速率的是
A.钢铁腐蚀 B. 食物腐败 C. 炼钢 D. 塑料老化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省宜宾市高二上学期期中测试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.pH=2的硫酸溶液中c(H+):c(OH-)等于2:1,稀释100倍后二者的比值改变
B.由水电离的c(H+)=10-12mol/L的溶液中:K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存
C.1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8
D.某温度下水的离子积为1.0×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为10:1
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三上学期11月阶段性测试化学试卷(解析版) 题型:实验题
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:

(1)验证固体W焙烧后产生的气体含有SO2的方法是________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。

装置A中发生反应的化学方程式为___________________。
(3)制备绿矾时,向溶液X中加入过量____________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用____________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中测试理综化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系不正确的是
A.若将适量CO2 通入0.1 mol·L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32ˉ)+ c(HCO3ˉ)= 0.1 mol·L-1
B.在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02)
C.常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前<N后
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期第二次月考化学试卷(解析版) 题型:选择题
莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液经常用于定量滴定实验,下列有关说法正确的是
A.配制0.1mol·L-1莫尔盐溶液500mL,需莫尔盐19.6克
B.可与含Fe2+、HClO、H+、Cl﹣微粒的溶液大量共存
C.加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42﹣+Fe2++2OH﹣=2BaSO4↓+Fe(OH)2↓
D.取样,加入浓NaOH溶液并加热,出现可让蓝色石蕊试纸变红的气体,证明含NH4+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二上学期第一次月考化学试卷(解析版) 题型:实验题
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如 图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
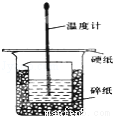
(1)本实验中还缺少一个仪器,其名称是 。
在大小烧杯中填充泡沫塑料的作用是 。
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差 (t2-t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容为:c=4.18×10-3kJ/(g·℃),则写出该反应的热化学方程式(离子方程式) (ΔH值保留到小数点后1位)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的△H____________(填“偏大”、“偏小”或“不变”)。
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热ΔH会____________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市兖州区高一上学期期中测试化学试卷(解析版) 题型:选择题
用NA表示阿伏德罗常数,下列叙述正确的是
A.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
B.标准状况下,22.4LH2O含有的分子数为 NA
C.通常状况下,NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣ 个数为 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com