
 乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同.
乙醇脱水反应在不同温度条件下得到产物组成不同.下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应的时间均相同. | 温度 (℃) | 乙醇转化率 (%) | 有机产物含量 (体积分数) | |
| 乙烯(%) | 乙醚(%) | ||
| 115 | 20 | 8.7 | 90.2 |
| 135 | 68 | 16.7 | 82.2 |
| 155 | 88 | 32.3 | 66.8 |
| 175 | 90 | 86.9 | 12.1 |
| ||
| 140℃ |
| [C2H5OC2H5]?[H2O] |
| [C2H5OH]2 |
| [C2H5OC2H5]?[H2O] |
| [C2H5OH]2 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| △ |

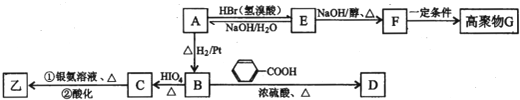
查看答案和解析>>
科目:高中化学 来源: 题型:
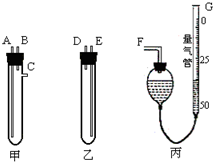 某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:
某中学化学实验室要求学生在实验室条件下,用标准卷尺、中学化学实验室常用的托盘天平和如图所示的仪器,再用稀硫酸和宽度、厚度均匀的纯镁带(镁带每米质量为2.5g左右)测定气体摩尔体积.假如实验是在标准状况下进行,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 ,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )
,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )| A、使用了过量的氧化剂 |
| B、没有用乙酸,而是使用了其它催化剂 |
| C、把反应混合物加热 |
| D、所生成的甲萘醌是沉淀物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡,再加入0.5 mL有机物Y,加热,未出现砖红色沉淀,说明Y中不含醛基 |
| B、取少量卤代烃Y在碱性溶液中水解,用硝酸酸化至酸性,再滴加AgNO3溶液,生成淡黄色沉淀,说明卤代烃中含有溴元素 |
| C、用玻璃棒蘸取新制氯水,滴在pH试纸上,然后与比色卡对照,可测定新制氯水的pH |
| D、向10mL 0.1 mol/L的AgNO3溶液中滴加10滴0.1 mol/L的NaCl溶液,有白色沉淀生成,再向其中滴加0.1 mol/L的KI溶液,沉淀变为黄色,说明相同温度下AgCl溶解度大于AgI的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应容器的压强不随时间而变化 |
| B、A气体和B气体的生成速率相等 |
| C、A、B、C三种气体的生成速率相等 |
| D、反应混合气体的密度不随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,c(Clˉ)>c(NH4+)>c(OHˉ)>c(H+) |
| B、10mL0.1mol/LNH4 Cl溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| C、10mL0.1mol/LCH3COOH溶液与5mL0.2mol/LNaOH溶液混合,c(Na+)=c(CH3COOˉ)>c(OHˉ)>c(H+) |
| D、10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合,c(Clˉ)>c(Na+)>c(OHˉ)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com