
| 实验内容以及现象 | 结论 |
| ①取少量N溶液滴加足量的硝酸钡溶液,无沉淀产生 | N中不含______离子 |
| ②______ | 确定M溶液中含有Na+,不含K+ |
③用pH试纸检测M溶液,pH试纸呈蓝色 | ______ |
| 实验内容以及现象 | 结论 |
| SO42- | |
| 对M进行焰色反应实验,焰色为黄色,透过蓝钴玻璃没有紫色 | 确定M溶液中含有Na+,不含K+ |
| 可能含AlO2-、CO32-、OH-, |


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
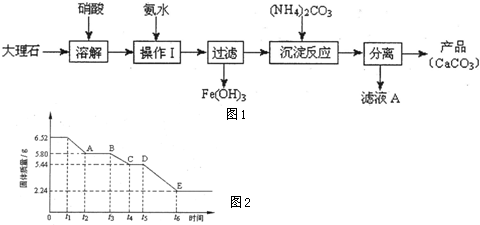
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

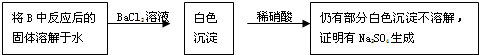
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
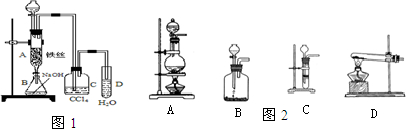
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | A | B | C | D |
| 试剂 | 氯水 | 氢氧化钠溶液 | 铁屑 | KSCN溶液 |
| 现象 | 出现黄褐色 | 最终生成红褐色沉淀 | 绿色 | 有较浅的血红色 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com