
常温下,向10mL0.1mol·L-1H2A溶液中逐滴加入0.1mol·L-1NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示分析判断,下列微粒浓度大小关系正确的是
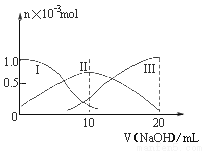
A. 当v=0时,c(H+)=c(OH-)+c(HA-)+c(A2-)
B. 当v=10时,c(Na+)=c(H2A)+c(HA-)+c(A2-)
C. 当v=20时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 当pH=7时,c(Na+)>c(HA-)+ c(A2-)
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源:2017届江西省、临川一中高三1月联考理综化学试卷(解析版) 题型:简答题
碳酸二甲酯(CH3OCOOCH3,简称DMC),是一种应用前景广泛的新材料,实验室中可用甲醇、CO、CO2等进行合成。回答下列问题:
(1)二氧化碳的电子式为 _________________
(2)用甲醇、CO、O2在常压、70~120℃和催化剂的条件下合成DMC。
已知:①CO的标准燃烧热为:?283.0kJ•mol?1,
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44kJ的热量
③2CH3OH(g)+CO2(g)?CH3OCOOCH3(g)+H2O(g)△H=?15.5kJ•mol?1
则2CH3OH(g)+CO(g)+1/2O2(g)?CH3OCOOCH3 (g)+H2O(l)△H=_____。
该反应在常压和70~120℃条件下就能自发反应的原因是_______________。
(3)由上述反应可知甲醇和CO2可直接合成DMC但甲醇转化率通常不会超过1%,制约该反应走向工业化生产.
①写出该反应平衡常数表达式:______________ ;
②在恒容密闭容器中发生上述反应,能说明已达到平衡状态的是____(选填编号).
A.v正(CH3OH)=2v逆(CO2)
B.CH3OCOOCH3与H2O的物质的量之比保持不变
C.容器内气体的密度不变D.容器内压强不变
③某研究小组在某温度下,在100mL恒容密闭容器中投入2.5mol CH3OH(g)、适量CO2和6×10?5 mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图1所示.(计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量)。
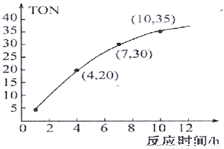
在该温度下,最佳反应时间是_________h;4~10h内DMC的平均反应速率是_______ .
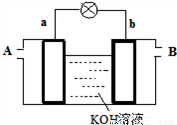
(4)以多孔铂为电极,在如下图装置中A、B口分别通入CH3OCOOCH3和O2构成燃料电池,请写出该电池负极的电极反应式____________________________
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 标准状况下NA个CH3CH2OH分子的体积约为22.4L
B. 1molCl2参加化学反应,转移的电子数一定为2NA
C. 23g14CO2与NO2的混合气体中,含O原子数、电子数分别为NA、11.5NA
D. 将标准状况下22.4L HCl气体通入1L、1mol/L的CH3COONa溶液,所得溶液中CH3COOH分子与CH3COO-离子的总数为NA
查看答案和解析>>
科目:高中化学 来源:2017届浙江省台州市高三上学期期末质量评估考试化学试卷(解析版) 题型:选择题
常温下,物质的量浓度相等的下列物质的水溶液,pH最小的是
A. NaOH B. FeCl3 C. Na2CO3 D. NaCl
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:简答题
高铁酸钾(K2FeO4)具有强氧化性,可作为水处理剂和高容量电池材料。工业上生产高铁酸钾的工艺流程如下:
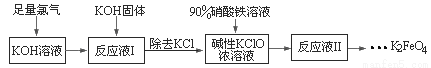
已知K2FeO4具有下列性质:①可溶于水,微溶于KOH溶液,难溶于异丙醇;②在0℃-5℃,强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2
请完成下列填空:
(1)已知Cl2与KOH在低温下可制得KClO,请写出化学反应方程式____________。
(2)在“反应液Ⅰ”中加KOH固体的目的是____________________。
(3)生产K2FeO4的化学反应方程式为________________,制备K2FeO4时,须将Fe(NO3)3溶液缓慢滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是___________________。
(4)请补充完整由“反应液Ⅱ”得到K2FeO4晶体的实验步骤。(可选用的试剂:NaOH溶液、KOH溶液、蒸馏水和异丙醇)
① 向反应液Ⅱ中加入饱和________,在冰水浴中静置结晶后过滤,得K2FeO4粗产品;
② 将K2FeO4粗产品溶解在___________中,再次在冰水浴中静置结晶后过滤,得到较纯净的K2FeO4;
③ 将K2FeO4晶体再用少量__________洗涤,低温真空干燥,得到高铁酸钾成品。
(5)从“反应液Ⅱ”中分离出K2FeO4晶体后,可以得到的副产品有_________(写化学式)。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
在给定的条件下,下列选项所示的物质间转化均能实现的是
A. H2SiO3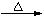 SiO2
SiO2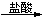 SiCl4 B. 浓HCl
SiCl4 B. 浓HCl Cl2
Cl2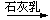 漂白粉
漂白粉
C. Fe Fe2O3
Fe2O3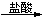 FeCl3 D. Mg(OH)2
FeCl3 D. Mg(OH)2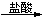 MgCl2(aq)
MgCl2(aq)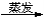 无水MgCl2
无水MgCl2
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期开学考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A. 核内有8个中子的碳原子: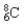 B. 18O2-的结构示意图:
B. 18O2-的结构示意图: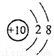
C. 羟基的电子式: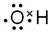 D. 淀粉和纤维素的结构简式:CH2O
D. 淀粉和纤维素的结构简式:CH2O
查看答案和解析>>
科目:高中化学 来源:2017届福建省漳州市八校高三2月联考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A. 1 mol Na2O2中含有的阴离子数为2NA
B. 标准状况下,由H2O2制得2.24LO2转移的电子数目为0.4NA
C. 常温常压下,8g O3含有4 NA个电子
D. 常温下,1L pH=2的H2SO4溶液中含有的H+数目为0.02NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省菏泽市高一上学期期末考试(B卷)化学试卷(解析版) 题型:简答题
(1)从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。

Ⅰ.海水所得粗盐中含Ca2+、Mg2+、SO - 等杂质,为了有效除去Ca2+、Mg2+、SO
- 等杂质,为了有效除去Ca2+、Mg2+、SO -,加入试剂的合理顺序为___________。
-,加入试剂的合理顺序为___________。
A.先加NaOH,后加Na2CO3,再加Ba2+试剂
B.先加NaOH,后加Ba2+试剂,再加Na2CO3
C.先加Ba2+试剂,后加NaOH,再加Na2CO3
要除去SO -,必须添加钡试剂,该钡试剂可以是___________。
-,必须添加钡试剂,该钡试剂可以是___________。
A.Ba(OH)2 B. Ba(NO3)2 C.BaCl2
Ⅱ.写出用Ca(OH)2制取氢氧化镁的化学方程式:_____________________。
从经济效益角度看,该化工厂的厂址应选择在__________________。
(2)海藻中提取碘的流程如图:
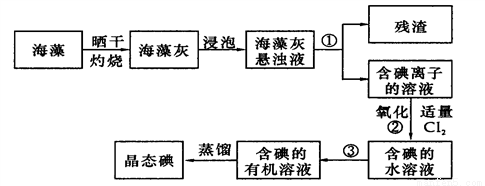
指出提取碘的过程中有关实验操作名称:①__________,③__________;
写出过程②中有关反应的离子方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com