
“神舟七号”成功登天标志着我国的航天事业进入了新的篇章。
(1)某空间站局部能量转化系统如下图所示,其中燃料电池采用KOH溶液为电解液,燃料电池放电时的负极反应式为______________________________________。如果某段时间内氢氧储罐中共收集到33.6 L(已折算成标况)气体,则该段时间内水电解系统中转移电子的物质的量为__________mol。
向日面时 背日面时
 —→
—→ —→
—→ —→
—→
(2)在载人航天器的生态系统中,不仅要求分离出CO2,还要求提供充足的O2。某种电化学装置可实现转化2CO2===2CO+O2,CO可用作燃料。已知该反应的阳极反应式为4OH--4e-===O2↑+2H2O,则阴极反应式为____________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某些化学键的键能如下表(单位kJ·mol-1),据此,回答下列问题:
| 键 | H—H | Br—Br | I—I | Cl—Cl | H—Cl | H—I | H—Br |
| 键能 | 436 | 193 | 151 | 247 | 431 | 299 | 356 |
(1)1 mol H2在2 mol Cl2中燃烧,放出的热量为____kJ。
(2)在一定条件下,1 mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是________。
a.Cl2>Br2>I2 b.I2>Br2>Cl2
预测1 mol H2在足量F2中燃烧比在Cl2中放热______。
查看答案和解析>>
科目:高中化学 来源: 题型:
将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为( )
A.4×10-3 mol·L-1 B.2×10-3 mol·L-1
C.1×10-3 mol·L-1 D.1×10-7 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为____________。
②图中A、B、C、D四个区域,生成铁锈最多的是__________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向。下列说法不正确的是( )
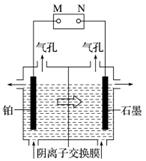
A.M是电源的负极
B.左侧气孔逸出的气体可能为副产物H2
C.电解槽中发生的总反应为MnSO4+2H2O MnO2+H2↑+H2SO4
MnO2+H2↑+H2SO4
D.若用阳离子交换膜代替阴离子交换膜,阳极可能得到MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程中体系的能量变化如图所示,下列说法错误的是( )
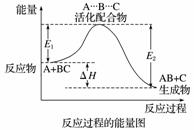
A.反应过程可表示为A+BC—→A…B…C—→AB+C
(反应物) (过渡态) (生成物)
B.E1为反应物的总能量与过渡态的能量差,称为正反应的活化能
C.正反应的热效应ΔH=E1-E2<0,所以正反应为放热反应
D.此图中逆反应的热效应ΔH=E1-E2<0,所以逆反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
依据反应事实书写热化学方程式
依据事实,写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+ O2(g)===SO2(g)+H2O(g) ΔH1
O2(g)===SO2(g)+H2O(g) ΔH1
2H2S(g)+SO2(g)=== S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
H2S(g)+ O2(g)===S(g)+H2O(g) ΔH3
O2(g)===S(g)+H2O(g) ΔH3
2S(g)===S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=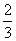 (ΔH1+ΔH2-3ΔH3)
(ΔH1+ΔH2-3ΔH3)
B.ΔH4=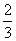 (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4= (ΔH1+ΔH2-3ΔH3)
(ΔH1+ΔH2-3ΔH3)
D.ΔH4= (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=11。
(1)该温度下水的离子积常数Kw=______________。
(2)在此温度下,将pH=a的NaOH溶液Va L与pH=b的硫酸Vb L混合。
①若所得混合液为中性,且a=12,b=2,则Va∶Vb=_____________。
②若所得混合液为中性,且a+b=12,则Va∶Vb=__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com