
【题目】日本产业技术综合研究所发布的锂空气电池的设计构思是负极采用金属锂条,中间设有用于隔开正极和负极的锂离子固体电解质,正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合,既可以用作充电电池也可用作燃料电池使用,结构如图所示。下列有关该锂空气电池说法不正确的是( )
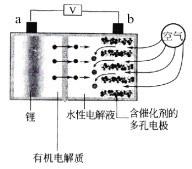
A.电池放电时,Li+穿过隔膜向b极移动得到LiOH溶液
B.放电时,外电路的电子由a经外电路流向b
C.充电时,a电极的电极反应为:Li+ + e- ═ Li
D.放电时,b极发生的电极反应为O2 - 4e- + 2H2O ═ 4OH-
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】如图所示,对该物质的说法正确的是
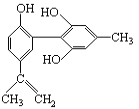
A. 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B. 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
C. 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为6 mol、7 mol
D. 该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①盐酸;②二氧化碳;③高锰酸钾;④铝;⑤自来水;⑥石墨;⑦液氧;⑧淀粉;⑨纯碱
(1)以上物质能导电的是_______________
(2)以上物质属于电解质的是___________
(3)以上物质属于非电解质的是_________
(4)从上述物质选出一种或几种进行反应,写出既是氧化还原反应,又是化合反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关。下列说法错误的是
A. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用盐酸除去
B. 废旧钢材焊接前,可依次用饱和Na2CO3溶液、饱和NH4Cl溶液处理焊点处
C. 使用含有氯化钠的融雪剂会加快桥梁的腐蚀
D. 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,在海洋循环中,通过下图所示的途径固碳。以下选项中相关说法不正确的是( )
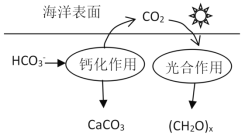
A.NaHCO3溶液中存在:c(H2CO3)+c(HCO3- )+c(OH-)=c(H+)
B.钙化作用的离子方程式为Ca2+ +2HCO3- ═CaCO3↓+CO2↑ + H2O
C.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3- )>c(H+)
D.若将标况下2.24 L CO2气体通入足量的NaOH溶液,所得溶液中存在:n(H2CO3)+n(HCO3- )+n(CO32-)=0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸________________________________________________________
(2)丙组实验混合溶液中离子浓度由大到小的顺序是_____________________________
(3)丁组实验所得混合溶液中由水电离出的c(OH-)=________________mol·L-1, 混合溶液中,c(Na+)-c(A-)=_________________________mol·L-1 (不能做近似计算)。
Ⅱ.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g)H=﹣92.4kJmol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
2NH3(g)H=﹣92.4kJmol-1,在773 K时,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1)从0~10min内,该反应的平均速率v(H2)=________________ ;该温度下,反应达到化学平衡时,化学平衡常数K=________________ (保留二位小数)
(2)该温度下,若向容积相同的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,下列各项标志着该反应达到化学平衡状态的是________(填字母)。
A.容器内N2、H2、NH3的浓度之比为1∶3∶2 B.3v正(N2)=v逆(H2)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)该温度下,分别将2 mol N2和6 mol H2充入在一个固定容积为1 L的密闭容器中,反应达到平衡过程中,c(H2)c(N2)c(NH3)随时间t变化如图曲线;在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)~t的曲线上相应的点为________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg(OH)2固体在水中达到溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),为使Mg(OH)2固体的量减少,可加入少量的
Mg2+(aq)+2OH-(aq),为使Mg(OH)2固体的量减少,可加入少量的
A. NH4Cl B. NaOH C. MgSO4 D. Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。
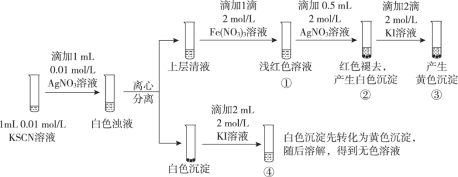
下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
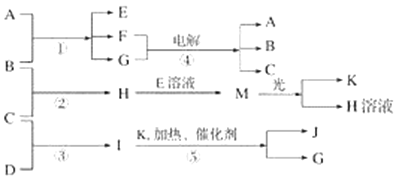
请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2)A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G_______________________________________________________。
(4)写出反应④的化学方程式____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com