
| A、金属钠与硫酸锌溶液反应置换出金属锌 |
| B、金属铁与硫酸溶液反应后所得溶液质量比原溶液的质量大 |
| C、在常温下,铝比镁更容易与氧气反应 |
| D、金属铜与氯化银反应得到金属银 |


科目:高中化学 来源: 题型:
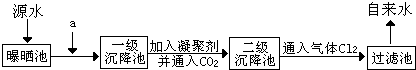
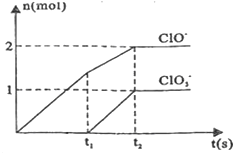
| 1 |
| 2 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
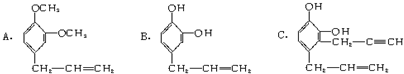
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠投入Ca(HCO3)2溶液,反应后有白色沉淀析出 |
| B、干粉灭火器能用于扑灭金属钠、钾的着火 |
| C、生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl |
| D、取用金属钠、钾时,所需实验用品有小刀、镊子、滤纸、玻璃片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
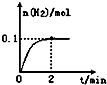 硫--碘循环分解水制氢主要涉及下列反应:
硫--碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息知识 |
| A | 其原子的质量数=质子数=电子层数 |
| E | 原子核外有4个原子轨道填充了电子 |
| X | 其外围电子排布式为:nsnnp2n |
| Y | 地壳中含量最多的金属元素 |
| Z | 能形成多种氧化物,其中一种氧化物是具有磁性的黑色晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com