
| A. | 1:1 | B. | 3:4 | C. | 2:3 | D. | 4:3 |
分析 令Fe的物质的量为1mol,根据方程式计算出生成氢气的物质的量,再根据相同条件下体积之比等于物质的量之比确定两反应中生成氢气体积之比.
解答 解:令Fe的物质的量为1mol,则:
Fe+2HCl=FeCl2+H2↑
1mol 1mol
3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
1mol $\frac{4}{3}$mol,
相同条件下体积之比等于物质的量之比,则两反应中生成氢气体积之比为1mol:$\frac{4}{3}$mol=3:4,
故选B.
点评 本题考查根据方程式的计算,比较基础,清楚铁与水蒸气的反应是关键,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 100 g含氢元素质量分数为12%的乙烯和乙醛(C2H4O)的混合物中,所含氧原子数目NA | |
| C. | 实验室制氯气的化学方程式:KClO3+6H37Cl(浓)═KCl+337Cl2↑+3H2O | |
| D. | 2.0 L 0.5 mo1/L NaAlO2溶液中含有氧原子的数目为 2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作和现象 | 结论 |
| A | 其他条件不变,缩小H2(g)+I2(g)?2HI(g)的平衡体系的容器容积,气体颜色变深 | 增大压强,平衡逆向移动 |
| B | 分别将乙烯与SO2通入酸性KMnO4溶液中,KMnO4溶液均褪色 | 两种气体使酸性KMnO4溶液褪色的原理不相同 |
| C | 用滴定管量取20.00mL稀硫酸,初读数时尖嘴管内有气泡,末读数时气泡消失 | 所取稀硫酸体积小于20.00mL |
| D | 25℃时,分别测定等物质的量浓度的NaCN溶液和NaF溶液的pH,前者pH大 | 酸性:HCN>HF |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,对正反应的反应速率影响更大 | |
| B. | 增大压强,对正反应的反应速率影响更大 | |
| C. | 减小反应物浓度,对逆反应的反应速率影响更大 | |
| D. | 加入催化剂,对逆反应的反应速率影响更大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的溴(KI溶液) | B. | 乙烷中的乙烯(KMnO4酸性溶液) | ||
| C. | 乙酸乙酯中的乙酸(饱和Na2CO3溶液) | D. | 苯中的甲苯(溴水) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
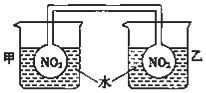 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2与水反应 | |
| B. | 水电解生成H2 和H2在O2中燃烧生成水的相互转化过程 | |
| C. | 工业合成氨 | |
| D. | 氨气与水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com